Wurtzovo pravilo reakcije. Mehanizam Wurtz-ove reakcije
Nazivne organske reakcije
U organskoj kemiji postoji ogroman broj reakcija koje nose ime istraživača koji je otkrio ili proučavao određenu reakciju.
Imenovane reakcije mogu se naći u mnogim priručnikima o organskoj kemiji, ali ja ih želim razdvojiti prema klasi kemijskog spoja. I, naravno, ovo nisu sve nominalne reakcije; ovo su reakcije koje se često susreću u školskom tečaju organske kemije.
Nazivne reakcije :
- Wurtz reakcija- "nominalna" reakcija produljenja lanca, točnije, udvostručenja broja ugljikovih atoma:
C2H5 Cl + 2Na +Cl C2H5 → C4H10 + 2NaCl (butan je dobiven iz etana)
- Reakcija Konovalova: S razrijeđenom dušičnom kiselinom pod tlakom alkani se nitriraju:
S2H6 + HNO3 (HO-NO2) → S2H5NO2 + H2O (nitroetan)
- Još jedna "nominalna" reakcija: Kolbeova reakcija: elektroliza soli:
2SH3COONa -(elektroliza)-→ SH3-CH3 (etan) + 2SO2 +2Na
Nazivne reakcije:
- Pridruživanje prema Markovnikovljevo pravilo:
vodik se veže za najhidrogeniraniji (= onaj s najviše vodika) atom ugljika dvostrukom vezom:
C H2=C H-CH3 + H Cl = CH3-C HCl -CH3
- Reverzna reakcija - dehidrogenacija - Zajcevljevo pravilo— vodik se oduzima vodikom najnezasićenijem (najmanje hidrogeniranom) ugljikovom atomu.
Nazivne reakcije:
- Reakcija Kucherova
CH 3 -C≡CH + H 2 O -> (katalizator - Hg 2+) -> CH 3 -C(=O)-CH 3

Nazivne reakcije
- Strukturna formula koju sada koristimo, "kućica za ptice", zove se Kekuleova formula:

- Zininova reakcija- redukcija nitrobenzena i njegovih nitrohomologa:

- Friedel-Kraftzova reakcija - alkilacija arena:

Kako se to može primijeniti na Jedinstveni državni ispit? Zamislite, bio je jednom ovakav zadatak u dijelu B:
Povežite nazivnu reakciju ili pravilo s određenom reakcijom ili željenim pravilom
1. Wurtzova reakcija 1. 2CH3CH2OH → CH2=CH–CH=CH2 (+ H2; + 2H2O)
2. Kucherovljeva reakcija 2. R–H + HNO3 → R–NO2 (+ H2O)
3. Reakcija Zelinskog 3. 2C2H5I + 2Na → n-C4H10 (+ 2NaI)
4. Konovalova reakcija 4. ciklo-C6H12 → C6H6 (+ 3H2)
5. Zininova reakcija 5. C2H2 + H2O → CH3CHO
6. Butlerova reakcija 6. C6H5NO2 + H2 (H+) → C6H5NH2
7. Markovnikovljevo pravilo 7. CH3CH2CH(OH)CH3 → CH3CH=CHCH3 (+ H2O)
8. Zajcevljevo pravilo 8. CH3CH2CH=CH2 + HCl → CH3CH2–CHCl–CH3
Općenito, takvi zadaci - nominalne reakcije - rijetki su na Jedinstvenom državnom ispitu, ali bolje je znati nego kasnije razbijati glavu o takvom problemu! I ponovno ponavljanje osnovnih organskih reakcija nije suvišno.
Više o ovoj temi:
 ,
kondenzacija alkil halida pod utjecajem Na (rjeđe Li ili K) uz stvaranje zasićenih ugljikovodika:
,
kondenzacija alkil halida pod utjecajem Na (rjeđe Li ili K) uz stvaranje zasićenih ugljikovodika: 2RHal + 2Na -> R-R + 2NaHal,
gdje je Hal obično Br ili I. Kada se koristi u okrugu, decomp. alkil halida (RHal i R"Hal) nastaje teško razdvojiva smjesa svih mogućih produkata (R-R, R"-R", R"-R).
V. r. odvija se lako ako alkil halid ima veliki mol. masa, a halogen je vezan na primarni C atom, proces se provodi na niskim temperaturama u otopinama za otapanje. Dakle, u THF reakcija se odvija brzo i uz dobar prinos čak i na -80 °C.
Pretpostavlja se da mehanizam reakcije uključuje stvaranje radikalnih iona i radikala:
Međutim, činjenica da je konfiguracija određenih optički aktivnih alkilnih halogenida (na primjer, 2-klorooktana u otopini s Na) obrnuta ne isključuje mogućnost heterolize. mehanizam.
reakciju je otkrio S. Wurtz 1855. godine i koristi se uglavnom za proizvodnju ugljikovodika s dugim ugljikovim lancem. U drugim slučajevima, posebno kod pripravljanja nesimetričnih alkana, dekomp. modifikacije V. r., o kojima se govori u nastavku.
Za sintezu masnih aromata. veza koristiti Fittigovu modifikaciju (Wurtz-Fittigovo rješenje):
ArHal + RHal + 2Na -> Ar-R + 2NaHal
reakciju koju je otkrio R. Fittig 1855. Alkani se često stvaraju u dobrom iskorištenju pomoću Grignardovog reagensa, npr.: 
Nesimetrični zasićeni ugljikovodici dobivaju se pomoću bakarorg. veza:
Otopina slična V. r. koristi se za sintezu elementoorg. veza i biciklički. veza, npr.: 
Lit.: Reakcije organometalnih spojeva kao redoks procesi, M., 1981, str. 16-38 (prikaz, ostalo). Npr. Ter-Gabrijel.
Korisni internetski resursi:
Iako se može zamisliti da se RR formira na sljedeći način:
gdje je M metal,
ali ipak glavni tok reakcije teče drugačijim putem:
Ova faza odvija se na sljedeći način:
Ova se reakcija može istovremeno smatrati i S N 2- i S E 2-supstitucijom, kao i "sinkronim" procesom s četiri centra (Palm, str. 315-316):
Istinski sinkroni mehanizam uključuje stvaranje kovalentne veze između metala M i halogena X. Međutim, proces tipa S E 2–S N 2, kada se suprotni naboji iona u nastajanju M + i X - nalaze u aktiviranom stanju u blizini i elektrostatski stabiliziraju jedan drugoga, što je ekvivalentno djelomičnom stvaranju ionske veze – također se mogu nazvati "sinkronim".
(3) Disproporcionalnost se može pojaviti kao nuspojava:
Zapravo, olefin RCH=CH 2 nastaje iz supstrata RCH 2 CH 2 Cl kao rezultat eliminacije E2 pod djelovanjem baze RSH 2 CH 2 y.
d) Bazno katalizirana Mannichova reakcija
Mannichova reakcija je reakcija aminometilacije. Kao amino komponenta koriste se sekundarni i primarni alifatski i aromatski amini, kao metilenska komponenta formaldehid (u obliku vodene otopine - formalin ili u obliku paraforma), a rjeđe - acetaldehid. Prethodno pripremljeni aminal može se koristiti kao sredstvo za aminometiliranje.
Sama amino komponenta može djelovati kao baza koja katalizira reakciju.
CH kiselina također može proći reakciju aminometilacije u enolnom obliku, tvoreći cikličko prijelazno stanje.
U kiselim sredinama, aminometilacija se odvija drugačijim mehanizmom, uz sudjelovanje visoko reaktivnog intermedijera - karbenij-imonijevog iona, koji je dušični analog formaldehida (ovdje se ne raspravlja o ovom mehanizmu; vidi Becker detaljno, str. 301-302). , 394-395; "Radionica", str. 150-155; ožujak, sv. 344-347).
3) Adicija preko dvostrukih veza (obično C=O)
Ova vrsta karbanionskih reakcija uključuje cijelu skupinu sintetski važnih reakcija:
a) Acilacija estera esterima (Claisenova kondenzacija)
b) Aldolna kondenzacija i druge slične reakcije
Bazno katalizirana aldolna kondenzacija temelji se na sposobnosti karbonilnog spoja da reagira i kao karboksilna kiselina (karbanion, tj. nukleofil) zbog kiselih a-C-H-vodika, i kao elektrofil zbog elektrofilnog karbonilnog ugljika.
U posljednjoj fazi, formirani alkoholatni ion oduzima proton iz prethodno formirane protonirane baze (ili iz otapala), pretvarajući se u nenabijeni produkt kondenzacije (b-hidroksialdehid ili b-hidroksiketon), a katalizator (hidroksidni ion) se regenerira . Preduvjet za provedbu ovog stupnja “neutralizacije” je veća bazičnost alkoholatnog iona (pK a 17-19) u odnosu na hidroksidni ion (pK a 15,7). Ako bazni katalizator ima veću bazičnost od alkoholatnog iona, tada se ne može dogoditi korak "neutralizacije" i za kondenzaciju se mora koristiti ekvimolarna količina baze. O primjeru takve kondenzacije bit će riječi kasnije.
Ako nastali b-hidroksikarbonilni spoj još uvijek sadrži kiseli a-C-H-vodik, tada je u jako alkalnom vodenom okruženju također sposoban formirati odgovarajući karbonilni spoj, koji se može vezati na molekulu izvornog karbonilnog spoja, itd. [Sykes, str. . 117-118]. S druge strane, budući da sadrži karbonilnu skupinu, može vezati karbanion ishodišnog spoja. Kao rezultat toga, kada jaka baza djeluje na aldehide kao što je acetaldehid, nastaju polimeri niske molekularne težine. Reakcija se može zaustaviti nakon prvog "jednostavnog" dodavanja korištenjem slabih baza kao što je kalijev karbonat.
Reakcije aldolne kondenzacije mogu se zakomplicirati procesom "krotonizacije" (krotonska kondenzacija). U zwitterionskom tautomernom obliku b-hidroksikarbonilnog spoja, snažno potisno okruženje nastaje uz sudjelovanje dvostruke veze kao vodiča istiskivanja elektrona [Palm, str. 377]:
U nastalom nezasićenom karbonilnom spoju dvostruka veza je konjugirana s karbonilnom skupinom, što donekle pridonosi njegovom stvaranju. Međutim, reakcija krotonizacije posebno je karakteristična za sustave s aromatskim supstituentima, budući da su i zwitterion i aktivirani kompleks koji sliči produktu reakcije stabilizirani konjugacijom dvostruke veze s p-elektronskim sustavom aromatskog prstena. Rezultat reakcije je ekvivalentan dehidraciji odgovarajućeg b-hidroksiketona (ili aldehida).
Treba napomenuti da je dehidracija izazvana bazama rijetka pojava. U pravilu se eliminacija molekule vode odvija u uvjetima kisele katalize.
Predložen je još jedan mehanizam krotonizacije, koji sugerira njegovu pojavu kroz karbanion b-hidroksikarbonilnog spoja [Sykes, str. 118]:
Reakcije mješovite aldolne kondenzacije, kao što su reakcije s dva različita aldehida, obično nemaju praktičnu važnost jer reakcija dvaju aldehida s dva iz njih izvedena aniona proizvodi smjesu četiri različita produkta. Međutim, neke "mješovite" aldolne reakcije mogu biti od praktičnog interesa ako jedan od karbonilnih ostataka, kao što je benzaldehid, ne može formirati karbanion i stoga može prihvatiti samo karbanion generiran iz drugog karbonilnog dijela. Primjer takve reakcije dat je gore, kada se razmatra mehanizam krotonizacije prema Palmu. Ova vrsta reakcije također uključuje reakciju aldolne kondenzacije (s krotonizacijom) acetaldehida s benzaldehidom:
Konvencionalna aldolna kondenzacija (tj. nemiješana) nije moguća za aldehide koji nemaju a-C-H veze, naime formaldehid HCHO, benzaldehid PhCHO ili R3 CCHO - i stoga nisu sposobni formirati karbanione tipa o kojem se govori. Kada bilo koji od ovih aldehida reagira s vodenom otopinom baze, hidroksilni ion se jednostavno pridružuje karbonilnoj skupini. Međutim, kada se koristi jaka baza u visokim koncentracijama, takvi aldehidi podliježu redoks disproporcioniranju (Cannizzarova reakcija), kada se od dvije molekule aldehida jedna oksidira u odgovarajuću kiselinu (u obliku aniona), a druga se reducira u odgovarajući alkohol:
Budući da je formaldehid, zbog visoke elektronegativnosti karbonilne skupine, još uvijek karboksilna kiselina, sposoban je za neku vrstu aldolne kondenzacije u alkalnom mediju:
Na taj način nastaju polihidroksialdehidi i ketoni, uključujući i predstavnike klase monosaharida.
Ako je karbonilna komponenta koja reagira s C–H kiselim karbonilnim spojem derivat karboksilne kiseline (ester, anhidrid, kiselinski halid), tada nužno dolazi do kondenzacije poput krotonske kondenzacije, samo su alkohol, karboksilna kiselina ili hidrohalid. eliminiran. Rezultat su rezonantno stabilizirani anioni (enolati) b-dikarbonilnih spojeva:
Zbog svoje niske bazičnosti, anioni b-dikarbonilnih spojeva, u pravilu, nisu u stanju regenerirati slobodnu bazu (na primjer, alkoksidni ion) iz protoniranog baznog "katalizatora", pa je potrebno koristiti ekvimolarnu količina osnovnog sredstva. Ako je X=OCOR ili Hal, tada je potreban još jedan mol baze; Dakle, u takvim slučajevima uzimaju se ukupno dva mola baze: 1 mol za stvaranje aniona C–H kiselog karbonilnog spoja i još 1 mol za neutralizaciju oslobođene kiseline RCOOH ili HHal.
Treba napomenuti da se aldolna kondenzacija također može dogoditi putem kiselinsko-katalitičkog mehanizma:
I protonske kiseline i Lewisove kiseline (na primjer, BF 3) mogu djelovati kao katalizatori. Kiseli katalizator povećava karbonilnu aktivnost i, dodatno, katalizira enolizaciju kisele komponente. Enol, zbog osnovnih svojstava dvostruke veze, napada karbonilnu skupinu kao nukleofilni reagens. Međutim, u kiseloj sredini nastali aldol odmah dehidrira, tj. kao rezultat dolazi do kondenzacije krotona.
Vidi također Reutov, sv. 1, str. 490-491.
WURZOVA REAKCIJA– kemijska reakcija koja omogućuje dobivanje najjednostavnijih organskih spojeva - zasićenih ugljikovodika. Sama Wurtzova reakcija sastoji se od kondenzacije alkilnih halogenida pod djelovanjem metalnog Na, Li ili rjeđe K: 2RHal + 2Na = R–R + 2NaHal.Ponekad se tumači kao interakcija RNa ili RLi s R"Hal.
Reakciju je otkrio francuski organski kemičar Charles Wurtz (1817. – 1884.) 1855. dok je pokušavao dobiti etil-natrij iz etil-klorida i metalnog natrija, iako Wurtz-ova reakcija rezultira stvaranjem nove ugljik-ugljik veze često se koristi u organskoj sintezi, uglavnom se koristi za dobivanje zasićenih ugljikovodika s dugim ugljikovim lancem, posebno je koristan u pripremi pojedinačnih ugljikovodika velike molekularne težine, i, kao što se može vidjeti iz gornjeg dijagrama, za dobivanje danom ugljikovodiku treba uzeti samo jedan alkil halid, budući da se kondenzacijom dva alkil halida dobiva smjesa sva tri moguća produkta spajanja.
Stoga, ako se koriste alkil halid i natrij, Wurtz reakcija može proizvesti samo ugljikovodike s parnim brojem ugljikovih atoma. Wurtz-ova reakcija se najuspješnije odvija s primarnim alkil jodidima. Vrlo niski prinosi ciljnog proizvoda dobiveni su primjenom Wurtz metode za sekundarne alkil halogenide. Reakcija se obično provodi u dietil eteru. Upotreba ugljikovodika kao otapala smanjuje selektivnost reakcije.
Međutim, ako koristite prethodno pripremljeni organometalni spoj, na primjer alkillitij, također možete dobiti asimetrične produkte kondenzacije:
RLi + R"Hal = R – R" + LiHal
U oba slučaja reakcija je popraćena stvaranjem velikog broja nusproizvoda zbog sporednih procesa. To je ilustrirano primjerom interakcije etil litija s 2-bromooktanom:
.
U ovom slučaju, 3-metilnonan i niz nusproizvoda u navedenim molarnim omjerima nastaju kao produkt Wurtz-ove reakcije.
Osim natrija, u Wurtz-ovoj reakciji korišteni su metali poput srebra, cinka, željeza, bakra i indija.
Wurtz-ova reakcija se uspješno koristi za intramolekularne kondenzacije za konstruiranje karbocikličkih sustava. Dakle, ciklopropan se može dobiti iz 1,3-dibromopropana pod djelovanjem metalnog cinka i natrijevog jodida (kao promotora reakcije):

Mogu se konstruirati i drugi napeti karbociklički sustavi. Na primjer, iz 1,3-dibromoadamantana, pomoću legure natrij-kalij, može se dobiti 1,3-dehidroadamantan:
 .
.I interakcija 1-bromo-3-kloro-ciklobutana s natrijem dovodi do biciklobutana:
 .
.Postoji niz poznatih varijanti Wurtz-ove reakcije, koje su dobile vlastita imena. To su Wurtz–Fittigova reakcija i Ullmannova reakcija. Prvi uključuje kondenzaciju alkil i aril halida pod djelovanjem natrija da se dobije alkil aromatski derivat. U slučaju Ullmannove reakcije, aril jodidi se obično uvode u kondenzaciju, a umjesto natrija koristi se svježe pripremljeni bakar. Ova reakcija omogućuje dobivanje raznih biarilnih derivata u visokom iskorištenju, uključujući one nesimetrične koji sadrže supstituent u jednom od aromatske jezgre:
 .
.Vjeruje se da se mehanizam Wurtzove reakcije sastoji od dvije glavne faze:
1) stvaranje organometalnog derivata (ako se koristi metal, a ne prethodno pripremljeni organometalni spoj):
RHal + 2Na = R–Na + NaHal,
2) interakcija formiranog organonatrijevog spoja, u ovom slučaju, s drugom molekulom alkil halida:
RHal + R–Na = RR + NaHal.
Ovisno o prirodi R i uvjetima reakcije, drugi stupanj procesa može teći ionskim ili radikalnim mehanizmom.
Izvori: Internet resursi
http://www.krugosvet.ru/enc/nauka_i_tehnika/himiya/REAKTSIYA_VYURTSA.html
Svaka klasa kemijskih spojeva može pokazati svojstva određena njihovom elektronskom strukturom. Alkane karakteriziraju reakcije supstitucije, eliminacije ili oksidacije molekula. Svi imaju svoje karakteristike, o kojima će se dalje raspravljati.
Što su alkani
To su zasićeni ugljikovodični spojevi koji se nazivaju parafini. Njihove se molekule sastoje samo od atoma ugljika i vodika, imaju linearni ili razgranati aciklički lanac, u kojem postoje samo pojedinačni spojevi. S obzirom na karakteristike klase, moguće je izračunati koje su reakcije karakteristične za alkane. Oni slijede formulu za cijeli razred: H 2n+2 C n.
Kemijska struktura
Molekula parafina sadrži atome ugljika koji pokazuju sp 3 hibridizaciju. Sve četiri valentne orbitale imaju isti oblik, energiju i smjer u prostoru. Kut između energetskih razina je 109° i 28".
Prisutnost jednostrukih veza u molekulama određuje koje su reakcije karakteristične za alkane. Sadrže σ-spojeve. Veza između ugljika je nepolarna i slabo polarizirajuća, nešto dulja nego u C−H. Dolazi i do pomaka elektronske gustoće prema atomu ugljika, kao najelektronegativnijem. Kao rezultat toga, spoj C−H karakterizira niska polarnost.
Supstitucijske reakcije
Tvari klase parafina imaju slabu kemijsku aktivnost. To se može objasniti snagom veza između C−C i C−H, koje se teško kidaju zbog nepolarnosti. Njihova destrukcija temelji se na homolitičkom mehanizmu, u kojem sudjeluju slobodni radikali. Zbog toga su za alkane karakteristične reakcije supstitucije. Takve tvari ne mogu djelovati s molekulama vode ili ionima koji nose naboj.
Smatraju se supstitucijom slobodnih radikala, u kojoj su atomi vodika zamijenjeni halogenim elementima ili drugim aktivnim skupinama. Takve reakcije uključuju procese povezane s halogeniranjem, sulfokloriranjem i nitriranjem. Njihov rezultat je proizvodnja derivata alkana.

Mehanizam reakcija supstitucije slobodnih radikala temelji se na tri glavne faze:
- Proces počinje inicijacijom ili nukleacijom lanca, uslijed čega nastaju slobodni radikali. Katalizatori su izvori ultraljubičastog svjetla i topline.
- Zatim se razvija lanac u kojem se odvijaju sekvencijalne interakcije aktivnih čestica s neaktivnim molekulama. Pretvaraju se u molekule, odnosno radikale.
- Posljednja faza bit će prekid lanca. Uočava se rekombinacija ili nestanak aktivnih čestica. Time se zaustavlja razvoj lančane reakcije.
Proces halogeniranja
Temelji se na mehanizmu radikalnog tipa. Reakcija halogeniranja alkana događa se nakon zračenja ultraljubičastim svjetlom i zagrijavanjem smjese halogena i ugljikovodika.
Sve faze procesa poštuju pravilo koje je izrazio Markovnikov. To ukazuje da se zamjenjuje halogenom, koji prvenstveno pripada samom hidrogeniranom ugljiku. Halogeniranje se odvija sljedećim redoslijedom: od tercijarnog atoma do primarnog ugljika.
Proces radi bolje za molekule alkana s dugim glavnim ugljikovim lancem. To je zbog smanjenja ionizirajuće energije u određenom smjeru; elektron se lakše odvaja od tvari.
Primjer je kloriranje molekule metana. Djelovanje ultraljubičastog zračenja dovodi do razgradnje klora na radikalne čestice koje napadaju alkan. Atomski vodik se izdvaja i nastaje H 3 C ili metilni radikal. Takva čestica pak napada molekularni klor, što dovodi do razaranja njegove strukture i stvaranja novog kemijskog reagensa.
U svakoj fazi procesa zamjenjuje se samo jedan atom vodika. Reakcija halogeniranja alkana dovodi do postupnog stvaranja molekula klorometana, diklorometana, triklorometana i tetraklorometana.
Shematski proces izgleda ovako:
H 4 C + Cl: Cl → H 3 CCl + HCl,
H 3 CCl + Cl: Cl → H 2 CCl 2 + HCl,
H 2 CCl 2 + Cl: Cl → HCl 3 + HCl,
HCl 3 + Cl: Cl → CCl 4 + HCl.
Za razliku od kloriranja molekule metana, provođenje takvog procesa s drugim alkanima karakterizirano je proizvodnjom tvari u kojima se zamjena vodika ne događa na jednom atomu ugljika, već na nekoliko. Njihov kvantitativni odnos povezan je s pokazateljima temperature. U hladnim uvjetima opaža se smanjenje brzine stvaranja derivata s tercijarnom, sekundarnom i primarnom strukturom.
S porastom temperature, brzina stvaranja takvih spojeva se smanjuje. Na proces halogeniranja utječe statički faktor, koji ukazuje na različitu vjerojatnost sudara radikala s atomom ugljika.

Proces halogeniranja s jodom ne događa se u normalnim uvjetima. Potrebno je stvoriti posebne uvjete. Kada se metan izloži ovom halogenu, pojavljuje se jodovodik. Na njega djeluje metil jodid, pri čemu se oslobađaju početni reagensi: metan i jod. Ova se reakcija smatra reverzibilnom.
Wurtzova reakcija za alkane
To je način proizvodnje sa simetričnom strukturom. Kao reaktanti koriste se metalni natrij, alkil bromidi ili alkil kloridi. Kada reagiraju, proizvode natrijev halid i povećani ugljikovodični lanac, koji je zbroj dva ugljikovodična radikala. Shematski sinteza izgleda ovako: R−Cl + Cl−R + 2Na → R−R + 2NaCl.
Wurtzova reakcija za alkane moguća je samo ako su halogeni u njihovim molekulama smješteni na primarnom ugljikovom atomu. Na primjer, CH3-CH2-CH2Br.
Ako u procesu sudjeluje smjesa halougljikovodika dvaju spojeva, tada pri kondenzaciji njihovih lanaca nastaju tri različita produkta. Primjer takve reakcije alkana je interakcija natrija s klorometanom i kloroetanom. Izlaz je smjesa koja sadrži butan, propan i etan.
Osim natrija, mogu se koristiti i drugi alkalijski metali, koji uključuju litij ili kalij.
Postupak sulfokloriranja
Naziva se i Reedova reakcija. Odvija se po principu supstitucije slobodnih radikala. tip reakcije alkana na djelovanje smjese sumporovog dioksida i molekularnog klora u prisutnosti ultraljubičastog zračenja.
Proces počinje pokretanjem lančanog mehanizma u kojem se iz klora proizvode dva radikala. Jedan od njih napada alkan, što dovodi do stvaranja alkilne vrste i molekule klorovodika. Sumporni dioksid se veže za ugljikovodični radikal i tvori složenu česticu. Za stabilizaciju, jedan atom klora je zarobljen iz druge molekule. Konačna tvar je alkan sulfonil klorid; koristi se u sintezi površinski aktivnih tvari.
Shematski proces izgleda ovako:
ClCl → hv ∙Cl + ∙Cl,
HR + ∙Cl → R∙ + HCl,
R∙ + OSO → ∙RSO 2 ,
∙RSO 2 + ClCl → RSO 2 Cl + ∙Cl.
Procesi povezani s nitracijom
Alkani reagiraju s dušičnom kiselinom u obliku 10%-tne otopine, kao i s četverovalentnim dušikovim oksidom u plinovitom stanju. Uvjeti za njegovu pojavu su visoke temperature (oko 140 °C) i niski tlakovi. Izlaz proizvodi nitroalkane.

Ovaj proces tipa slobodnih radikala dobio je ime po znanstveniku Konovalovu, koji je otkrio sintezu nitracije: CH 4 + HNO 3 → CH 3 NO 2 + H 2 O.
Mehanizam cijepanja
Alkane karakteriziraju reakcije dehidrogenacije i krekiranja. Molekula metana prolazi kroz potpunu toplinsku razgradnju.
Glavni mehanizam gornjih reakcija je odvajanje atoma od alkana.
Proces dehidrogenacije
Kada se atomi vodika odvoje od ugljikovog kostura parafina, s izuzetkom metana, dobivaju se nezasićeni spojevi. Takve kemijske reakcije alkana odvijaju se u uvjetima visokih temperatura (od 400 do 600 °C) i pod utjecajem akceleratora u obliku platine, nikla i aluminija.
Ako su u reakciji uključene molekule propana ili etana, tada će njezini produkti biti propen ili eten s jednom dvostrukom vezom.
Dehidrogenacijom kostura od četiri ili pet ugljika nastaju dienski spojevi. Butadien-1,3 i butadien-1,2 nastaju iz butana.
Ako reakcija sadrži tvari sa 6 ili više ugljikovih atoma, nastaje benzen. Ima aromatski prsten s tri dvostruke veze.
Proces povezan s razgradnjom
Na visokim temperaturama može doći do reakcija alkana s kidanjem ugljikovih veza i stvaranjem aktivnih čestica radikalskog tipa. Takvi se procesi nazivaju krekiranje ili piroliza.
Zagrijavanje reaktanata na temperature veće od 500 °C dovodi do razgradnje njihovih molekula, pri čemu nastaju složene smjese radikala alkilnog tipa.

Provođenje pirolize alkana s dugim ugljikovim lancima pod jakim zagrijavanjem povezano je s proizvodnjom zasićenih i nezasićenih spojeva. Naziva se toplinskim krekiranjem. Ovaj se postupak koristio do sredine 20. stoljeća.
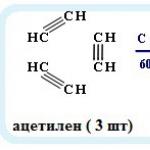
Nedostatak je bila proizvodnja ugljikovodika s niskim oktanskim brojem (ne više od 65), pa je zamijenjen proces se odvija u temperaturnim uvjetima koji su ispod 440 ° C i vrijednostima tlaka manjim od 15 atmosfera, u prisutnosti. aluminosilikatnog akceleratora s oslobađanjem alkana koji imaju razgranatu strukturu. Primjer je piroliza metana: 2CH 4 → t ° C 2 H 2 + 3H 2. Tijekom te reakcije nastaju acetilen i molekularni vodik.
Molekula metana može doživjeti konverziju. Ova reakcija zahtijeva vodu i katalizator od nikla. Izlaz je mješavina ugljičnog monoksida i vodika.
Oksidativni procesi
Kemijske reakcije karakteristične za alkane uključuju gubitak elektrona.
Postoji autooksidacija parafina. Uključuje slobodni radikalni mehanizam oksidacije zasićenih ugljikovodika. Tijekom reakcije iz tekuće faze alkana nastaju hidroperoksidi. U početnoj fazi, molekula parafina stupa u interakciju s kisikom, što rezultira oslobađanjem aktivnih radikala. Zatim, druga molekula O 2 stupa u interakciju s alkilnom česticom, što rezultira ∙ROO. Molekula alkana dolazi u kontakt s peroksidnim radikalom masne kiseline, nakon čega se oslobađa hidroperoksid. Primjer je autooksidacija etana:
C 2 H 6 + O 2 → ∙C 2 H 5 + HOO∙,
∙C 2 H 5 + O 2 → ∙OOC 2 H 5,
∙OOC 2 H 5 + C 2 H 6 → HOOC 2 H 5 + ∙C 2 H 5.
Alkane karakteriziraju reakcije izgaranja, koje su među glavnim kemijskim svojstvima pri određivanju u sastavu goriva. Oni su oksidativne prirode uz oslobađanje topline: 2C 2 H 6 + 7O 2 → 4CO 2 + 6H 2 O.
Ako se u procesu uoči mala količina kisika, tada konačni produkt može biti ugljen ili ugljikov dvovalentni oksid, što je određeno koncentracijom O 2 .
Kada se alkani oksidiraju pod utjecajem katalitičkih tvari i zagrijavaju na 200 °C, dobivaju se molekule alkohola, aldehida ili karboksilne kiseline.
Primjer etana:
C 2 H 6 + O 2 → C 2 H 5 OH (etanol),
C 2 H 6 + O 2 → CH 3 CHO + H 2 O (etanal i voda),
2C 2 H 6 + 3O 2 → 2CH 3 COOH + 2H 2 O (etanska kiselina i voda).

Alkani se mogu oksidirati kada su izloženi tročlanim cikličkim peroksidima. To uključuje dimetildioksiran. Rezultat oksidacije parafina je molekula alkohola.
Predstavnici parafina ne reagiraju na KMnO 4 ili kalijev permanganat, kao ni na
Izomerizacija
Za alkane, tip reakcije karakterizira supstitucija s elektrofilnim mehanizmom. To uključuje izomerizaciju ugljikovog lanca. Ovaj proces katalizira aluminijev klorid, koji stupa u interakciju sa zasićenim parafinom. Primjer je izomerizacija molekule butana, koja postaje 2-metilpropan: C 4 H 10 → C 3 H 7 CH 3.
Proces aromatiziranja
Zasićene tvari koje sadrže šest ili više ugljikovih atoma u glavnom ugljikovom lancu sposobne su za dehidrociklizaciju. Ova reakcija nije tipična za kratke molekule. Rezultat je uvijek šesteročlani prsten u obliku cikloheksana i njegovih derivata.

U prisutnosti akceleratora reakcije odvija se daljnja dehidrogenacija i transformacija u stabilniji benzenski prsten. Aciklički ugljikovodici se pretvaraju u aromatske spojeve ili arene. Primjer je dehidrociklizacija heksana:
H 3 C−CH 2 − CH 2 − CH 2 − CH 2 − CH 3 → C 6 H 12 (cikloheksan),
C6H12 → C6H6 + 3H2 (benzen).