Wurtz sinteza. Mehanizam Wurtz-ove reakcije
WURZOVA REAKCIJA– kemijska reakcija koja omogućuje dobivanje najjednostavnijih organskih spojeva - zasićenih ugljikovodika.
Sama Wurtzova reakcija sastoji se od kondenzacije alkilnih halogenida pod djelovanjem metalnog Na, Li ili rjeđe K:
2RHal + 2Na ® R–R + 2NaHal.
Ponekad se tumači kao interakcija RNa ili RLi s R"Hal.
Reakciju je otkrio francuski organski kemičar Charles Wurtz (1817. – 1884.) 1855. dok je pokušavao dobiti etil natrij iz etil klorida i metalnog natrija.
Iako Wurtzova reakcija rezultira stvaranjem nove ugljik-ugljik veze, ne koristi se često u organskoj sintezi. Uglavnom se uz njegovu pomoć dobivaju zasićeni ugljikovodici s dugim ugljikovim lancem, posebno je koristan u dobivanju pojedinačnih ugljikovodika velike molekulske mase, a kao što se vidi iz gornjeg dijagrama, za dobivanje određenog ugljikovodika dovoljan je samo jedan alkil halid treba uzeti, budući da kondenzacija dva alkil halida rezultira smjesom sva tri moguća kombinirana produkta. Stoga, ako se koriste alkil halid i natrij, Wurtz reakcija može proizvesti samo ugljikovodike s parnim brojem ugljikovih atoma. Wurtz-ova reakcija se najuspješnije odvija s primarnim alkil jodidima. Vrlo niski prinosi ciljnog proizvoda dobiveni su primjenom Wurtz metode za sekundarne alkil halogenide. Reakcija se obično provodi u dietil eteru. Upotreba ugljikovodika kao otapala smanjuje selektivnost reakcije.
Međutim, ako koristite prethodno pripremljeni organometalni spoj, na primjer alkillitij, također možete dobiti asimetrične produkte kondenzacije:
RLi + R"Hal ® R – R" + LiHal
U oba slučaja reakcija je popraćena stvaranjem velikog broja nusproizvoda zbog sporednih procesa. To je ilustrirano primjerom interakcije etil litija s 2-bromooktanom:
U ovom slučaju, 3-metilnonan i niz nusproizvoda u navedenim molarnim omjerima nastaju kao produkt Wurtz-ove reakcije.
Osim natrija, u Wurtz-ovoj reakciji korišteni su metali poput srebra, cinka, željeza, bakra i indija.
Wurtz-ova reakcija se uspješno koristi za intramolekularne kondenzacije za konstruiranje karbocikličkih sustava. Dakle, ciklopropan se može dobiti iz 1,3-dibromopropana pod djelovanjem metalnog cinka i natrijevog jodida (kao promotora reakcije):
Mogu se konstruirati i drugi napeti karbociklički sustavi. Na primjer, iz 1,3-dibromoadamantana, pomoću legure natrij-kalij, može se dobiti 1,3-dehidroadamantan:
I interakcija 1-bromo-3-kloro-ciklobutana s natrijem dovodi do biciklobutana:
Postoji niz poznatih varijanti Wurtz-ove reakcije, koje su dobile vlastita imena. To su Wurtz–Fittigova reakcija i Ullmannova reakcija. Prvi uključuje kondenzaciju alkil i aril halida pod djelovanjem natrija da se dobije alkil aromatski derivat. U slučaju Ullmannove reakcije, aril jodidi se obično uvode u kondenzaciju, a umjesto natrija koristi se svježe pripremljeni bakar. Ova reakcija omogućuje dobivanje raznih biarilnih derivata u visokom iskorištenju, uključujući one nesimetrične koji sadrže supstituent u jednom od aromatske jezgre:
Vjeruje se da se mehanizam Wurtzove reakcije sastoji od dvije glavne faze:
1) stvaranje organometalnog derivata (ako se koristi metal, a ne prethodno pripremljeni organometalni spoj):
RHal + 2Na ® R–Na + NaHal,
2) interakcija formiranog organonatrijevog spoja, u ovom slučaju, s drugom molekulom alkil halida:
RHal + R–Na ® RR + NaHal.
Ovisno o prirodi R i uvjetima reakcije, drugi stupanj procesa može teći ionskim ili radikalnim mehanizmom.
Vladimir Korolkov
Svaka klasa kemijskih spojeva može pokazati svojstva određena njihovom elektronskom strukturom. Alkane karakteriziraju reakcije supstitucije, eliminacije ili oksidacije molekula. Svi imaju svoje karakteristike, o kojima će se dalje raspravljati.
Što su alkani
To su zasićeni ugljikovodični spojevi koji se nazivaju parafini. Njihove se molekule sastoje samo od atoma ugljika i vodika, imaju linearni ili razgranati aciklički lanac, u kojem postoje samo pojedinačni spojevi. S obzirom na karakteristike klase, moguće je izračunati koje su reakcije karakteristične za alkane. Oni slijede formulu za cijeli razred: H 2n+2 C n.
Kemijska struktura
Molekula parafina sadrži atome ugljika koji pokazuju sp 3 hibridizaciju. Sve četiri valentne orbitale imaju isti oblik, energiju i smjer u prostoru. Kut između energetskih razina je 109° i 28".
Prisutnost jednostrukih veza u molekulama određuje koje su reakcije karakteristične za alkane. Sadrže σ-spojeve. Veza između ugljika je nepolarna i slabo polarizirajuća, nešto dulja nego u C−H. Dolazi i do pomaka elektronske gustoće prema atomu ugljika, kao najelektronegativnijem. Kao rezultat toga, spoj C−H karakterizira niska polarnost.
Supstitucijske reakcije
Tvari klase parafina imaju slabu kemijsku aktivnost. To se može objasniti snagom veza između C−C i C−H, koje se teško kidaju zbog nepolarnosti. Njihova destrukcija temelji se na homolitičkom mehanizmu, u kojem sudjeluju slobodni radikali. Zbog toga su za alkane karakteristične reakcije supstitucije. Takve tvari ne mogu djelovati s molekulama vode ili ionima koji nose naboj.
Smatraju se supstitucijom slobodnih radikala, u kojoj su atomi vodika zamijenjeni halogenim elementima ili drugim aktivnim skupinama. Takve reakcije uključuju procese povezane s halogeniranjem, sulfokloriranjem i nitriranjem. Njihov rezultat je proizvodnja derivata alkana.

Mehanizam reakcija supstitucije slobodnih radikala temelji se na tri glavne faze:
- Proces počinje inicijacijom ili nukleacijom lanca, uslijed čega nastaju slobodni radikali. Katalizatori su izvori ultraljubičastog svjetla i topline.
- Zatim se razvija lanac u kojem se odvijaju sekvencijalne interakcije aktivnih čestica s neaktivnim molekulama. Pretvaraju se u molekule, odnosno radikale.
- Posljednja faza bit će prekid lanca. Uočava se rekombinacija ili nestanak aktivnih čestica. Time se zaustavlja razvoj lančane reakcije.
Proces halogeniranja
Temelji se na mehanizmu radikalnog tipa. Reakcija halogeniranja alkana događa se nakon zračenja ultraljubičastim svjetlom i zagrijavanjem smjese halogena i ugljikovodika.
Sve faze procesa poštuju pravilo koje je izrazio Markovnikov. To ukazuje da se zamjenjuje halogenom, koji prvenstveno pripada samom hidrogeniranom ugljiku. Halogeniranje se odvija sljedećim redoslijedom: od tercijarnog atoma do primarnog ugljika.
Proces radi bolje za molekule alkana s dugim glavnim ugljikovim lancem. To je zbog smanjenja ionizirajuće energije u određenom smjeru; elektron se lakše odvaja od tvari.
Primjer je kloriranje molekule metana. Djelovanje ultraljubičastog zračenja dovodi do razgradnje klora na radikalne čestice koje napadaju alkan. Atomski vodik se izdvaja i nastaje H 3 C ili metilni radikal. Takva čestica pak napada molekularni klor, što dovodi do razaranja njegove strukture i stvaranja novog kemijskog reagensa.
U svakoj fazi procesa zamjenjuje se samo jedan atom vodika. Reakcija halogeniranja alkana dovodi do postupnog stvaranja molekula klorometana, diklorometana, triklorometana i tetraklorometana.
Shematski proces izgleda ovako:
H 4 C + Cl: Cl → H 3 CCl + HCl,
H 3 CCl + Cl: Cl → H 2 CCl 2 + HCl,
H 2 CCl 2 + Cl: Cl → HCl 3 + HCl,
HCl 3 + Cl: Cl → CCl 4 + HCl.
Za razliku od kloriranja molekule metana, provođenje takvog procesa s drugim alkanima karakterizirano je proizvodnjom tvari u kojima se zamjena vodika ne događa na jednom atomu ugljika, već na nekoliko. Njihov kvantitativni odnos povezan je s pokazateljima temperature. U hladnim uvjetima opaža se smanjenje brzine stvaranja derivata s tercijarnom, sekundarnom i primarnom strukturom.
S porastom temperature, brzina stvaranja takvih spojeva se smanjuje. Na proces halogeniranja utječe statički faktor, koji ukazuje na različitu vjerojatnost sudara radikala s atomom ugljika.

Proces halogeniranja s jodom ne događa se u normalnim uvjetima. Potrebno je stvoriti posebne uvjete. Kada se metan izloži ovom halogenu, pojavljuje se jodovodik. Na njega djeluje metil jodid, pri čemu se oslobađaju početni reagensi: metan i jod. Ova se reakcija smatra reverzibilnom.
Wurtzova reakcija za alkane
To je način proizvodnje sa simetričnom strukturom. Kao reaktanti koriste se metalni natrij, alkil bromidi ili alkil kloridi. Kada reagiraju, proizvode natrijev halid i povećani ugljikovodični lanac, koji je zbroj dva ugljikovodična radikala. Shematski sinteza izgleda ovako: R−Cl + Cl−R + 2Na → R−R + 2NaCl.
Wurtzova reakcija za alkane moguća je samo ako su halogeni u njihovim molekulama smješteni na primarnom ugljikovom atomu. Na primjer, CH3-CH2-CH2Br.
Ako u procesu sudjeluje smjesa halougljikovodika dvaju spojeva, tada pri kondenzaciji njihovih lanaca nastaju tri različita produkta. Primjer takve reakcije alkana je interakcija natrija s klorometanom i kloroetanom. Izlaz je smjesa koja sadrži butan, propan i etan.
Osim natrija, mogu se koristiti i drugi alkalijski metali, koji uključuju litij ili kalij.
Postupak sulfokloriranja
Naziva se i Reedova reakcija. Odvija se po principu supstitucije slobodnih radikala. tip reakcije alkana na djelovanje smjese sumporovog dioksida i molekularnog klora u prisutnosti ultraljubičastog zračenja.
Proces počinje pokretanjem lančanog mehanizma u kojem se iz klora proizvode dva radikala. Jedan od njih napada alkan, što dovodi do stvaranja alkilne vrste i molekule klorovodika. Sumporni dioksid se veže za ugljikovodični radikal i tvori složenu česticu. Za stabilizaciju, jedan atom klora je zarobljen iz druge molekule. Konačna tvar je alkan sulfonil klorid; koristi se u sintezi površinski aktivnih tvari.
Shematski proces izgleda ovako:
ClCl → hv ∙Cl + ∙Cl,
HR + ∙Cl → R∙ + HCl,
R∙ + OSO → ∙RSO 2 ,
∙RSO 2 + ClCl → RSO 2 Cl + ∙Cl.
Procesi povezani s nitracijom
Alkani reagiraju s dušičnom kiselinom u obliku 10%-tne otopine, kao i s četverovalentnim dušikovim oksidom u plinovitom stanju. Uvjeti za njegovu pojavu su visoke temperature (oko 140 °C) i niski tlakovi. Izlaz proizvodi nitroalkane.

Ovaj proces tipa slobodnih radikala dobio je ime po znanstveniku Konovalovu, koji je otkrio sintezu nitracije: CH 4 + HNO 3 → CH 3 NO 2 + H 2 O.
Mehanizam cijepanja
Alkane karakteriziraju reakcije dehidrogenacije i krekiranja. Molekula metana prolazi kroz potpunu toplinsku razgradnju.
Glavni mehanizam gornjih reakcija je odvajanje atoma od alkana.
Proces dehidrogenacije
Kada se atomi vodika odvoje od ugljikovog kostura parafina, s izuzetkom metana, dobivaju se nezasićeni spojevi. Takve kemijske reakcije alkana odvijaju se u uvjetima visokih temperatura (od 400 do 600 °C) i pod utjecajem akceleratora u obliku platine, nikla i aluminija.
Ako su u reakciji uključene molekule propana ili etana, tada će njezini produkti biti propen ili eten s jednom dvostrukom vezom.
Dehidrogenacijom kostura od četiri ili pet ugljika nastaju dienski spojevi. Butadien-1,3 i butadien-1,2 nastaju iz butana.
Ako reakcija sadrži tvari sa 6 ili više ugljikovih atoma, nastaje benzen. Ima aromatski prsten s tri dvostruke veze.
Proces povezan s razgradnjom
Na visokim temperaturama može doći do reakcija alkana s kidanjem ugljikovih veza i stvaranjem aktivnih čestica radikalskog tipa. Takvi se procesi nazivaju krekiranje ili piroliza.
Zagrijavanje reaktanata na temperature veće od 500 °C dovodi do razgradnje njihovih molekula, pri čemu nastaju složene smjese radikala alkilnog tipa.

Provođenje pirolize alkana s dugim ugljikovim lancima pod jakim zagrijavanjem povezano je s proizvodnjom zasićenih i nezasićenih spojeva. Naziva se toplinskim krekiranjem. Ovaj se postupak koristio do sredine 20. stoljeća.
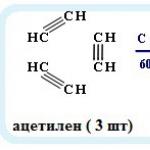
Nedostatak je bila proizvodnja ugljikovodika s niskim oktanskim brojem (ne više od 65), pa je zamijenjen proces se odvija u temperaturnim uvjetima koji su ispod 440 ° C i vrijednostima tlaka manjim od 15 atmosfera, u prisutnosti. aluminosilikatnog akceleratora s oslobađanjem alkana koji imaju razgranatu strukturu. Primjer je piroliza metana: 2CH 4 → t ° C 2 H 2 + 3H 2. Tijekom te reakcije nastaju acetilen i molekularni vodik.
Molekula metana može doživjeti konverziju. Ova reakcija zahtijeva vodu i katalizator od nikla. Izlaz je mješavina ugljičnog monoksida i vodika.
Oksidativni procesi
Kemijske reakcije karakteristične za alkane uključuju gubitak elektrona.
Postoji autooksidacija parafina. Uključuje slobodni radikalni mehanizam oksidacije zasićenih ugljikovodika. Tijekom reakcije iz tekuće faze alkana nastaju hidroperoksidi. U početnoj fazi, molekula parafina stupa u interakciju s kisikom, što rezultira oslobađanjem aktivnih radikala. Zatim, druga molekula O 2 stupa u interakciju s alkilnom česticom, što rezultira ∙ROO. Molekula alkana dolazi u kontakt s peroksidnim radikalom masne kiseline, nakon čega se oslobađa hidroperoksid. Primjer je autooksidacija etana:
C 2 H 6 + O 2 → ∙C 2 H 5 + HOO∙,
∙C 2 H 5 + O 2 → ∙OOC 2 H 5,
∙OOC 2 H 5 + C 2 H 6 → HOOC 2 H 5 + ∙C 2 H 5.
Alkane karakteriziraju reakcije izgaranja, koje su među glavnim kemijskim svojstvima pri određivanju u sastavu goriva. Oni su oksidativne prirode uz oslobađanje topline: 2C 2 H 6 + 7O 2 → 4CO 2 + 6H 2 O.
Ako se u procesu uoči mala količina kisika, tada konačni produkt može biti ugljen ili ugljikov dvovalentni oksid, što je određeno koncentracijom O 2 .
Kada se alkani oksidiraju pod utjecajem katalitičkih tvari i zagrijavaju na 200 °C, dobivaju se molekule alkohola, aldehida ili karboksilne kiseline.
Primjer etana:
C 2 H 6 + O 2 → C 2 H 5 OH (etanol),
C 2 H 6 + O 2 → CH 3 CHO + H 2 O (etanal i voda),
2C 2 H 6 + 3O 2 → 2CH 3 COOH + 2H 2 O (etanska kiselina i voda).

Alkani se mogu oksidirati kada su izloženi tročlanim cikličkim peroksidima. To uključuje dimetildioksiran. Rezultat oksidacije parafina je molekula alkohola.
Predstavnici parafina ne reagiraju na KMnO 4 ili kalijev permanganat, kao ni na
Izomerizacija
Za alkane, tip reakcije karakterizira supstitucija s elektrofilnim mehanizmom. To uključuje izomerizaciju ugljikovog lanca. Ovaj proces katalizira aluminijev klorid, koji stupa u interakciju sa zasićenim parafinom. Primjer je izomerizacija molekule butana, koja postaje 2-metilpropan: C 4 H 10 → C 3 H 7 CH 3.
Proces aromatiziranja
Zasićene tvari koje sadrže šest ili više ugljikovih atoma u glavnom ugljikovom lancu sposobne su za dehidrociklizaciju. Ova reakcija nije tipična za kratke molekule. Rezultat je uvijek šesteročlani prsten u obliku cikloheksana i njegovih derivata.

U prisutnosti akceleratora reakcije odvija se daljnja dehidrogenacija i transformacija u stabilniji benzenski prsten. Aciklički ugljikovodici se pretvaraju u aromatske spojeve ili arene. Primjer je dehidrociklizacija heksana:
H 3 C−CH 2 − CH 2 − CH 2 − CH 2 − CH 3 → C 6 H 12 (cikloheksan),
C6H12 → C6H6 + 3H2 (benzen).
WURZOVA REAKCIJA– kemijska reakcija koja omogućuje dobivanje najjednostavnijih organskih spojeva - zasićenih ugljikovodika.
Sama Wurtzova reakcija sastoji se od kondenzacije alkilnih halogenida pod djelovanjem metalnog Na, Li ili rjeđe K:
2RHal + 2Na ® R–R + 2NaHal.
Ponekad se tumači kao interakcija RNa ili RLi s R"Hal.
Reakciju je otkrio francuski organski kemičar Charles Wurtz (1817. – 1884.) 1855. dok je pokušavao dobiti etil natrij iz etil klorida i metalnog natrija.
Iako Wurtzova reakcija rezultira stvaranjem nove ugljik-ugljik veze, ne koristi se često u organskoj sintezi. Uglavnom se uz njegovu pomoć dobivaju zasićeni ugljikovodici s dugim ugljikovim lancem, posebno je koristan u dobivanju pojedinačnih ugljikovodika velike molekulske mase, a kao što se vidi iz gornjeg dijagrama, za dobivanje određenog ugljikovodika dovoljan je samo jedan alkil halid treba uzeti, budući da kondenzacija dva alkil halida rezultira smjesom sva tri moguća kombinirana produkta. Stoga, ako se koriste alkil halid i natrij, Wurtz reakcija može proizvesti samo ugljikovodike s parnim brojem ugljikovih atoma. Wurtz-ova reakcija se najuspješnije odvija s primarnim alkil jodidima. Vrlo niski prinosi ciljnog proizvoda dobiveni su primjenom Wurtz metode za sekundarne alkil halogenide. Reakcija se obično provodi u dietil eteru. Upotreba ugljikovodika kao otapala smanjuje selektivnost reakcije.
Međutim, ako koristite prethodno pripremljeni organometalni spoj, na primjer alkillitij, također možete dobiti asimetrične produkte kondenzacije:
RLi + R"Hal ® R – R" + LiHal
U oba slučaja reakcija je popraćena stvaranjem velikog broja nusproizvoda zbog sporednih procesa. To je ilustrirano primjerom interakcije etil litija s 2-bromooktanom:
U ovom slučaju, 3-metilnonan i niz nusproizvoda u navedenim molarnim omjerima nastaju kao produkt Wurtz-ove reakcije.
Osim natrija, u Wurtz-ovoj reakciji korišteni su metali poput srebra, cinka, željeza, bakra i indija.
Wurtz-ova reakcija se uspješno koristi za intramolekularne kondenzacije za konstruiranje karbocikličkih sustava. Dakle, ciklopropan se može dobiti iz 1,3-dibromopropana pod djelovanjem metalnog cinka i natrijevog jodida (kao promotora reakcije):
Mogu se konstruirati i drugi napeti karbociklički sustavi. Na primjer, iz 1,3-dibromoadamantana, pomoću legure natrij-kalij, može se dobiti 1,3-dehidroadamantan:
I interakcija 1-bromo-3-kloro-ciklobutana s natrijem dovodi do biciklobutana:
Postoji niz poznatih varijanti Wurtz-ove reakcije, koje su dobile vlastita imena. To su Wurtz–Fittigova reakcija i Ullmannova reakcija. Prvi uključuje kondenzaciju alkil i aril halida pod djelovanjem natrija da se dobije alkil aromatski derivat. U slučaju Ullmannove reakcije, aril jodidi se obično uvode u kondenzaciju, a umjesto natrija koristi se svježe pripremljeni bakar. Ova reakcija omogućuje dobivanje raznih biarilnih derivata u visokom iskorištenju, uključujući one nesimetrične koji sadrže supstituent u jednom od aromatske jezgre:
Vjeruje se da se mehanizam Wurtzove reakcije sastoji od dvije glavne faze:
1) stvaranje organometalnog derivata (ako se koristi metal, a ne prethodno pripremljeni organometalni spoj):
RHal + 2Na ® R–Na + NaHal,
2) interakcija formiranog organonatrijevog spoja, u ovom slučaju, s drugom molekulom alkil halida:
RHal + R–Na ® RR + NaHal.
Ovisno o prirodi R i uvjetima reakcije, drugi stupanj procesa može teći ionskim ili radikalnim mehanizmom.
Vladimir Korolkov
. P. Fittig proširio je Wurtzovu reakciju na područje aromatskih ugljikovodika
Suvremeni pristup Wurtz-ovoj reakciji
Kako bi se prevladali mnogi sporedni procesi, predloženo je korištenje selektivnijih i suvremenijih metoda. U tijeku je veliki napredak u korištenju metala koji nisu natrij. Za izvođenje Wurtzove reakcije koriste se srebro, cink, željezo i piroforno olovo. Potonji reagens omogućuje izvođenje reakcije u prisutnosti karboksilne skupine.
Intramolekularna Wurtzova reakcija
U 90-im godinama XIX stoljeća. Freund i Gustafson predložili su intramolekularnu varijantu. Dakle, 1,3-dibromopropan se može uspješno pretvoriti u ciklopropan djelovanjem cinka u prisutnosti natrijevog jodida kao aktivatora. Ovim putem bilo je moguće dobiti bispirociklopropan i biciklobutan. Kasnije je predloženo stvaranje Grignardovih intermedijera, koji naknadno, nakon djelovanja srebrovog trifluoroacetata, dovode do intramolekularnog unakrsnog spajanja. Ova metoda nije primjenjiva za dobivanje prosječnih ciklusa.
Linkovi
Zaklada Wikimedia. 2010. godine.
Pogledajte što je "Wurtz reakcija" u drugim rječnicima:
Wurtzova reakcija ili Wurtzova sinteza je metoda za sintezu simetričnih zasićenih ugljikovodika djelovanjem metalnog natrija na alkil halogenide (obično bromide ili jodide): 2RBr + 2Na → R R + 2NaBr Wurtzovu reakciju otkrio je S. A. Wurtz ( 1855). P. Fittig... ... Wikipedia
Metoda sinteze zasićenih ugljikovodika djelovanjem metalnog natrija na alkil halogenide (obično bromide ili jodide): 2RBr + 2Na → R R + 2NaBr. B. str. otkrio S. A. Wurtz. (1855). P. Fittig distribuirao je V. r. na…… Velika sovjetska enciklopedija
Kondenzacija alkilhalogenida pod utjecajem Na (rjeđe Li ili K) uz stvaranje zasićenih ugljikovodika: 2RHal + 2Na > RHR + 2NaHal, gdje je Hal obično Br ili I. Pri upotrebi u prehrani razg. nastaju alkil halogenidi (RHal i RHal)... ... Kemijska enciklopedija
- ... Wikipedia
Sinteza org. spojeva pomoću Magniorg. halogenidi RMgHal (Grignardovi reagensi). Potonji se obično primaju u omjeru: RHal + Mg > RMgHal. U ovom slučaju, r r RHal u dietil eteru polako se dodaje uz miješanje u suspenziju Mg u istoj tekućini... Kemijska enciklopedija
Pogledajte Wurtzovu reakciju... Kemijska enciklopedija
Priprava b hidroksikarbonatnih estera t interakcija. aldehidi ili ketoni s prisutnim halokarbonskim esterima. Zh (tzv. klasični P.p.): Razl. aldehidi i ketoni (zasićeni ili nezasićeni, aromatski, ... ... Kemijska enciklopedija
U organskoj kemiji postoji ogroman broj reakcija koje nose ime istraživača koji je otkrio ili proučavao određenu reakciju. Često se u nazivu reakcije pojavljuju imena nekoliko znanstvenika: to mogu biti autori prve objave (na primjer, ... ... Wikipedia
Ovaj članak govori o kemijskim spojevima. Za kanadsku aluminijsku tvrtku pogledajte Rio Tinto Alcan... Wikipedia
Charles Adolphe Würtz Charles Adolphe Würtz ... Wikipedia
knjige
- Život izvanrednih uređaja, Arkadij Iskanderovič Kuramšin, Kako kemičar može postati slavan? Jako jednostavno! Reakcija koju je otkrio, nova tvar ili čak reagens mogu se nazvati po njemu! Ali ako to nije dovoljno, onda takav znanstvenik ima još jedan... Kategorija: Kemijske znanosti Serija: Znanstveni pop Runeta Izdavač: AST,
- Life of remarkable devices, Kuramshin A., Kako kemičar može postati slavan? Jako jednostavno! Reakcija koju je otkrio, nova tvar ili čak reagens mogu se nazvati po njemu! Ali ako to nije dovoljno, onda takav znanstvenik ima još jedan... Kategorija:
2.1. Reakcija Butlerova A.M.
Dobivanje šećera iz formaldehida pod djelovanjem lužina:
Reakcija rezultira mješavinom šećera.
2.2. Wagnerova reakcija E.E.
Oksidacija alkena u cis - α - glikolima djelovanjem razrijeđene otopine kalijeva permanganata u alkalnom mediju (hidroksilacija):

2.3. Wurtz reakcija
Dobivanje ugljikovodika kondenzacijom alkilhalogenida pod djelovanjem metalnog natrija:

2.4. Wurtz-Grignardova reakcija
Stvaranje ugljikovodika tijekom reakcije alkil (aril) halida s Grignardovim reagensom:

2.5. Wurtz-Fittigova reakcija
Dobivanje masnih aromatskih ugljikovodika kondenzacijom aromatskih halogenih derivata s alkil halogenidima u prisutnosti natrija:


2.6. Harriesova reakcija
Oksidativno cijepanje alkena ozonizacijom i naknadnom hidrolizom (ozonoliza):

2.7. Gutterman-Kochova reakcija
Reakcija formilacije aromatskih ugljikovodika djelovanjem ugljikovog monoksida i klorovodika u prisutnosti AlCl3:

2.8. Reakcija Gell-Volhard-Zelinskog
Dobivanje α-halogeniranih kiselina djelovanjem klora ili broma u prisutnosti fosfora:

2.9. Hoffmannova reakcija
Dobivanje alifatskih amina alkilacijom amonijaka s alkil halogenidima:
2.10. Hoffmannova reakcija (preuređivanje)
Pregradnja kiselinskih amida u primarne amine uz gubitak jednog atoma ugljika u otopini hipoklorita:
2.11. Grignardove reakcije (sinteza organomagnezija)
Reakcije za sintezu organskih spojeva temeljene na dodatku Grignardovog reagensa na >C = O vezu:

2.12. Diels-Alderova reakcija (sinteza diena)
Adicija spojeva s aktiviranom dvostrukom vezom (dienofili) konjugiranim dienima radi stvaranja cikličkih struktura. Veza je napravljena prema tipu 1.4:

2.13. Sandmeyerova reakcija
Zamjena diazo skupine u aromatskim spojevima s halogenom ili drugom skupinom djelovanjem jednovalentnih bakrenih soli:

2.14. Reakcija Zelinskog
Dobivanje α-aminokiselina iz aldehida ili ketona djelovanjem smjese kalijevog cijanida i amonijevog klorida (amonijev cijanid):

2.15. Zininova reakcija
Redukcija aromatskih nitro spojeva u amine:

Zinin je koristio amonijev sulfid za redukciju u industriji, strugotine od lijevanog željeza koriste se u kiseloj sredini za redukciju nitro spojeva.
2.16. Reakcija Jocića
Priprava alkinilmagnezijevih halogenida (Jocic reagensi) pomoću Grignardovog reagensa:
2.17. Cannizzarova reakcija
Redoks disproporcioniranje dviju molekula aromatskog aldehida u odgovarajući alkohol i kiselinu pod djelovanjem lužina. Ova reakcija također uključuje alifatske i heterocikličke aldehide koji ne sadrže mobilni vodik u α položaju:

Cannizzarova križna reakcija

2.18. Claisenova reakcija (kondenzacija)
Dobivanje estera cimetne kiseline kondenzacijom aromatskih aldehida s esterima karboksilnih kiselina i karbonilnim spojevima.
2.19. Kolbeova reakcija
Proizvodnja ugljikovodika elektrolizom otopina alkalnih soli alifatskih karboksilnih kiselina:
Na anodi se kiselinski anion ispušta u nestabilni kiselinski radikal, koji se razgrađuje uz oslobađanje ugljičnog dioksida, a nastali alkilni radikali spajaju se u ugljikovodik:

2. 20. Kolbe-Schmittova reakcija
Dobivanje aromatskih hidroksi kiselina toplinskom karboksilacijom fenolata alkalijskih metala s ugljikovim dioksidom:

2. 21. Reakcija Konovalova
Nitracija alifatskih, alicikličkih i masno-aromatskih spojeva dušičnom kiselinom (12-20%):

2.22. Reakcija Kucherova
Katalitička hidratacija acetilena, njegovih homologa i derivata uz stvaranje aldehida i ketona:
a) kada se acetilen hidratizira, dobiva se acetaldehid:

b) hidratacijom homologa acetilena nastaju ketoni:

2.23. Reakcija Lebedeva
Priprema butadiena katalitičkom pirolizom (450˚C) etilnog alkohola:
2.24. Perkinova reakcija
Dobivanje α,β - nezasićenih kiselina kondenzacijom aromatskih aldehida s anhidridima karboksilnih kiselina:

2.25. Raschigova reakcija
Industrijska proizvodnja fenola katalitičkim kloriranjem benzena praćeno hidrolizom klorobenzena vodenom parom:

2.26. Reakcija Reformatskog
Dobivanje β - hidroksikarboksilnih kiselina interakcijom aldehida ili ketona s esterima α - halokarboksilnih kiselina pod utjecajem metalnog cinka:

2.27. Reakcija Rodionova
Dobivanje β-aminokiselina kondenzacijom aldehida s malonskom kiselinom i amonijakom u otopini alkohola:

2.28. Tiščenkova reakcija
Kondenzacija aldehida u estere pod utjecajem aluminijevih alkoholata:

2.29. Reakcija Favorskog
Interakcija alkina s aldehidima i ketonima:
2.30. Friedel-Craftsova reakcija
Alkilacija ili acilacija aromatskih spojeva s alkil ili acil halogenidima u prisutnosti aluminijevog klorida:
a) alkilacija:

b) aciliranje:

2.31. Chichibabin reakcija
Reakcija piridina s natrijevim amidom (α-aminacija):

2.32. Reakcija Čugajev-Cerevitinov
Interakcija organskih spojeva koji sadrže mobilni atom vodika s Grignardovim reagensom uz oslobađanje metana:
2.33. Schiffova reakcija
Interakcija aldehida s aminima u prisutnosti lužina dovodi do stvaranja azometina (Schiffovih baza):

2.34. Streckerova reakcija
Dobivanje α-aminokiselina iz aldehida i ketona djelovanjem amonijaka i cijanovodične kiseline, nakon čega slijedi hidroliza nastalih aminonitrila:
2.35. Jurijeva reakcija