Relativna masa atoma vodika. Relativna atomska masa elementa
Mase atoma i molekula su vrlo male, pa je zgodno izabrati masu jednog od atoma kao mjernu jedinicu i izraziti mase preostalih atoma u odnosu na nju. Upravo je to učinio utemeljitelj atomske teorije Dalton, koji je sastavio tablicu atomskih masa, uzimajući za jedinicu masu atoma vodika.
Do 1961. u fizici se kao atomska jedinica mase (amu) uzimala 1/16 mase atoma kisika 16 O, au kemiji 1/16 prosječne atomske mase prirodnog kisika, koji je mješavina tri izotopa. Kemijska jedinica mase bila je 0,03% veća od fizičke.
Trenutno je jedinstveni mjerni sustav usvojen u fizici i kemiji. Standardna jedinica atomske mase je 1/12 mase 12 C atoma ugljika.
1 amu = 1/12 m(12 C) = 1,66057×10 -27 kg = 1,66057×10 -24 g.
DEFINICIJA
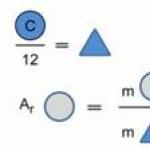
Relativna atomska masa elementa (A r) je bezdimenzijska veličina jednaka omjeru prosječne mase atoma nekog elementa prema 1/12 mase atoma 12 C.
Pri izračunavanju relativne atomske mase uzima se u obzir brojnost izotopa elemenata u zemljinoj kori. Na primjer, klor ima dva izotopa 35 Cl (75,5%) i 37 Cl (24,5%). Relativna atomska masa klora je:
A r (Cl) = (0,755 × m (35 Cl) + 0,245 × m (37 Cl)) / (1/12 × m (12 C) = 35,5.
Iz definicije relativne atomske mase slijedi da je prosječna apsolutna masa atoma jednaka relativnoj atomskoj masi pomnoženoj s amu:
m(Cl) = 35,5 × 1,66057 × 10 -24 = 5,89 × 10 -23 g.
Primjeri rješavanja problema
PRIMJER 1
| Vježbajte | U kojoj je od navedenih tvari maseni udio elementa kisika veći: a) u cinkovom oksidu (ZnO); b) u magnezijevom oksidu (MgO)? |
| Riješenje |
Nađimo molekularnu težinu cinkovog oksida: Mr (ZnO) = Ar(Zn) + Ar(O); Mr (ZnO) = 65+ 16 = 81. Poznato je da je M = Mr, što znači M(ZnO) = 81 g/mol. Tada će maseni udio kisika u cinkovom oksidu biti jednak: ω (O) = Ar (O) / M (ZnO) × 100 %; ω(O) = 16 / 81 × 100% = 19,75%. Nađimo molekulsku masu magnezijevog oksida: Mr (MgO) = Ar(Mg) + Ar(O); Mr (MgO) = 24+ 16 = 40. Poznato je da je M = Mr, što znači M(MgO) = 60 g/mol. Tada će maseni udio kisika u magnezijevom oksidu biti jednak: ω (O) = Ar (O) / M (MgO) × 100 %; ω(O) = 16 / 40 × 100% = 40%. Dakle, maseni udio kisika veći je u magnezijevom oksidu, budući da je 40 > 19,75. |
| Odgovor | Maseni udio kisika veći je u magnezijevom oksidu. |
PRIMJER 2
| Vježbajte | U kojem je od navedenih spojeva maseni udio metala veći: a) u aluminijevu oksidu (Al 2 O 3); b) u željeznom oksidu (Fe 2 O 3)? |
| Riješenje | Maseni udio elementa X u molekuli sastava NX izračunava se pomoću sljedeće formule: ω (X) = n × Ar (X) / M (HX) × 100 %. Izračunajmo maseni udio svakog elementa kisika u svakom od predloženih spojeva (zaokružit ćemo vrijednosti relativnih atomskih masa preuzetih iz periodnog sustava D.I. Mendelejeva na cijele brojeve). Nađimo molekulsku težinu aluminijevog oksida: Mr (Al 2 O 3) = 2×Ar(Al) + 3×Ar(O); Mr (Al 2 O 3) = 2×27 + 3×16 = 54 + 48 = 102. Poznato je da je M = Mr, što znači M(Al 2 O 3) = 102 g/mol. Tada će maseni udio aluminija u oksidu biti jednak: ω (Al) = 2×Ar(Al) / M (Al 2 O 3) × 100%; ω(Al) = 2×27 / 102 × 100% = 54 / 102 × 100% = 52,94%. Nađimo molekulsku težinu željezovog (III) oksida: Mr (Fe 2 O 3) = 2×Ar(Fe) + 3×Ar(O); Mr (Fe 2 O 3) = 2×56+ 3×16 = 112 + 48 = 160. Poznato je da je M = Mr, što znači M(Fe 2 O 3) = 160 g/mol. Tada će maseni udio željeza u oksidu biti jednak: ω (O) = 3 × Ar (O) / M (Fe 2 O 3) × 100 %; ω(O) = 3×16 / 160×100% = 48 / 160×100% = 30%. Dakle, maseni udio metala veći je u aluminijevom oksidu, budući da je 52,94 > 30. |
| Odgovor | Maseni udio metala veći je u aluminijevom oksidu. |
Iz materijala lekcije naučit ćete da se atomi nekih kemijskih elemenata razlikuju od atoma drugih kemijskih elemenata po masi. Učitelj će vam reći kako su kemičari mjerili masu atoma koji su toliko mali da ih ne možete vidjeti ni elektronskim mikroskopom.
Tema: Početne kemijske ideje
Lekcija: Relativna atomska masa kemijskih elemenata
Početkom 19.st. (150 godina nakon rada Roberta Boylea), engleski znanstvenik John Dalton predložio je metodu za određivanje mase atoma kemijskih elemenata. Razmotrimo suštinu ove metode.
Dalton je predložio model prema kojem molekula složene tvari sadrži samo jedan atom različitih kemijskih elemenata. Na primjer, vjerovao je da se molekula vode sastoji od 1 atoma vodika i 1 atoma kisika. Prema Daltonu, jednostavne tvari također sadrže samo jedan atom kemijskog elementa. Oni. molekula kisika mora se sastojati od jednog atoma kisika.
A onda, znajući masene udjele elemenata u tvari, lako je odrediti koliko se puta masa atoma jednog elementa razlikuje od mase atoma drugog elementa. Tako je Dalton vjerovao da je maseni udio elementa u tvari određen masom njezina atoma.
Poznato je da je maseni udio magnezija u magnezijevom oksidu 60%, a maseni udio kisika 40%. Slijedeći Daltonov način razmišljanja, možemo reći da je masa atoma magnezija 1,5 puta veća od mase atoma kisika (60/40 = 1,5):
Znanstvenik je primijetio da je masa atoma vodika najmanja, jer Ne postoji složena tvar u kojoj bi maseni udio vodika bio veći od masenog udjela nekog drugog elementa. Stoga je predložio usporedbu masa atoma elemenata s masom atoma vodika. I na taj je način izračunao prve vrijednosti relativnih (u odnosu na atom vodika) atomskih masa kemijskih elemenata.
Atomska masa vodika uzeta je kao jedinica. A vrijednost relativne mase sumpora bila je 17. Ali sve dobivene vrijednosti bile su približne ili netočne, jer eksperimentalna tehnika tog vremena bila je daleko od savršene i Daltonova pretpostavka o sastavu tvari bila je netočna.
Godine 1807.-1817 Švedski kemičar Jons Jakob Berzelius proveo je opsežna istraživanja kako bi razjasnio relativne atomske mase elemenata. Uspio je dobiti rezultate bliske modernim.
Mnogo kasnije od Berzeliusovog rada, mase atoma kemijskih elemenata počele su se uspoređivati s 1/12 mase ugljikovog atoma (slika 2).

Riža. 1. Model za izračunavanje relativne atomske mase kemijskog elementa
Relativna atomska masa kemijskog elementa pokazuje koliko je puta masa atoma kemijskog elementa veća od 1/12 mase atoma ugljika.
Relativna atomska masa označava se s A r i nema mjernih jedinica jer pokazuje omjer masa atoma.
Na primjer: A r (S) = 32, tj. atom sumpora je 32 puta teži od 1/12 mase atoma ugljika.
Apsolutna masa 1/12 ugljikovog atoma je referentna jedinica, čija se vrijednost izračunava s velikom točnošću i iznosi 1,66 * 10 -24 g ili 1,66 * 10 -27 kg. Ta se referentna masa naziva jedinica atomske mase (a.e.m.).
Nema potrebe pamtiti vrijednosti relativnih atomskih masa kemijskih elemenata; one su dane u bilo kojem udžbeniku ili priručniku o kemiji, kao iu periodnom sustavu D.I. Mendeljejev.
Prilikom izračunavanja vrijednosti relativnih atomskih masa obično se zaokružuju na cijele brojeve.
Iznimka je relativna atomska masa klora - za klor se koristi vrijednost od 35,5.
1. Zbirka zadataka i vježbi iz kemije: 8. razred: uz udžbenik P.A. Orzhekovsky i dr. “Kemija, 8. razred” / P.A. Orzhekovsky, N.A. Titov, F.F. Hegel. – M.: AST: Astrel, 2006.
2. Ushakova O.V. Radna bilježnica iz kemije: 8. razred: uz udžbenik P.A. Orzhekovsky i dr. “Kemija. 8. razred” / O.V. Ushakova, P.I. Bespalov, P.A. Orzhekovsky; pod, ispod. izd. prof. godišnje Orzhekovsky - M.: AST: Astrel: Profizdat, 2006. (str. 24-25)
3. Kemija: 8. razred: udžbenik. za opće obrazovanje ustanove / P.A. Orzhekovsky, L.M. Meshcheryakova, L.S. Pontak. M.: AST: Astrel, 2005. (§10)
4. Kemija: inorg. kemija: udžbenik. za 8. razred. opće obrazovanje ustanove / G.E. Rudzitis, Fyu Feldman. – M.: Obrazovanje, OJSC “Moscow Textbooks”, 2009. (§§8,9)
5. Enciklopedija za djecu. Svezak 17. Kemija / Pogl. ur.V.A. Volodin, Ved. znanstveni izd. I. Leenson. – M.: Avanta+, 2003.
Dodatni web resursi
1. Objedinjena zbirka digitalnih obrazovnih izvora ().
2. Elektronička verzija časopisa “Chemistry and Life” ().
Domaća zadaća
str.24-25 Broj 1-7 iz Radne bilježnice iz kemije: 8. razred: udžbeniku P.A. Orzhekovsky i dr. “Kemija. 8. razred” / O.V. Ushakova, P.I. Bespalov, P.A. Orzhekovsky; pod, ispod. izd. prof. godišnje Orzhekovsky - M.: AST: Astrel: Profizdat, 2006.
Trenutno se uzima da je jedinica atomske mase jednaka 1/12 mase neutralnog atoma najčešćeg izotopa ugljika 12 C, tako da je atomska masa tog izotopa po definiciji točno 12. Razlika između atomske mase izotopa i njegov maseni broj naziva se višak mase (obično se izražava u MeV). Može biti ili pozitivna ili negativna; razlog njenog nastanka je nelinearna ovisnost energije vezanja jezgri o broju protona i neutrona, kao i razlika u masama protona i neutrona.
Ovisnost atomske mase izotopa o masenom broju je sljedeća: višak mase je pozitivan za vodik-1, s povećanjem masenog broja opada i postaje negativan dok se ne postigne minimum za željezo-56, tada počinje raste i povećava se na pozitivne vrijednosti za teške nuklide. To odgovara činjenici da fisija jezgri težih od željeza oslobađa energiju, dok fisija lakih jezgri zahtijeva energiju. Naprotiv, spajanje jezgri lakših od željeza oslobađa energiju, dok spajanje elemenata težih od željeza zahtijeva dodatnu energiju.
Priča
Sve do 1960-ih atomska masa bila je definirana tako da je nuklid kisik-16 imao atomsku masu 16 (kisikova ljestvica). Međutim, omjer kisika-17 i kisika-18 u prirodnom kisiku, koji je također korišten u izračunima atomske mase, rezultirao je dvjema različitim tablicama atomskih masa. Kemičari su koristili ljestvicu koja se temeljila na činjenici da bi prirodna mješavina izotopa kisika imala atomsku masu 16, dok su fizičari isti broj 16 dodijelili atomskoj masi najčešćeg izotopa kisika (koji ima osam protona i osam neutrona ).
Linkovi
Zaklada Wikimedia. 2010.
Pogledajte što je "atomska masa" u drugim rječnicima:
Masa atoma, izražena u jedinicama atomske mase. Atomska masa manja je od zbroja masa čestica koje čine atom (protona, neutrona, elektrona) za iznos određen energijom njihove interakcije (vidi, na primjer, Defekt mase) ... Veliki enciklopedijski rječnik
Atomska masa je masa atoma kemijskog elementa, izražena u jedinicama atomske mase (a.m.u.). Za 1 amu Prihvaća se 1/12 mase izotopa ugljika s atomskom masom 12. 1 amu = 1,6605655 10 27 kg. Atomsku masu čine mase svih protona i... Pojmovi nuklearne energije
atomska masa- je masa atoma elementa, izražena u jedinicama atomske mase. Masa elementa koji sadrži isti broj atoma kao 12 g izotopa 12C. Opća kemija: udžbenik / A. V. Zholnin ... Kemijski pojmovi
ATOMSKA MASA- bezdimenzijska količina. A. m. masa atoma kemikalija. element izražen u atomskim jedinicama (vidi) ... Velika politehnička enciklopedija
- (zastarjeli izraz atomska težina), relativna vrijednost mase atoma, izražena u jedinicama atomske mase (a.m.u.). A.m je manji od zbroja masa konstitutivnih atoma po defektu mase. A. m. za osnovu je uzeo D. I. Mendeljejev. karakteristika elementa kada ... ... Fizička enciklopedija
atomska masa- - [Ya.N.Luginsky, M.S.Fezi Zhilinskaya, Yu.S.Kabirov. Englesko-ruski rječnik elektrotehnike i elektroenergetike, Moskva, 1999] Teme elektrotehnike, osnovni pojmovi EN atomska težina ... Vodič za tehničke prevoditelje
Masa atoma, izražena u jedinicama atomske mase. Atomska masa kemijskog elementa koji se sastoji od mješavine izotopa uzima se kao prosječna vrijednost atomske mase izotopa, uzimajući u obzir njihov postotni sadržaj (ova vrijednost je dana u periodičnim... ... enciklopedijski rječnik
Pojam ove veličine doživio je dugotrajne promjene u skladu s promjenama u pojmu atoma. Prema Daltonovoj teoriji (1803.), svi atomi istog kemijskog elementa su identični i njegova atomska masa je broj jednak... ... Collierova enciklopedija
atomska masa- santykinė atominė masė statusas T sritis Standardizacija i mjeriteljstvo apibrėžtis Cheminio elemento vidutinės masės ir nuklido ¹²C atomo masės 1/12 dalies dalmuo. atitikmenys: engl. atomska masa; atomska težina; relativna atomska masa vok. Atommasse…
atomska masa- santykinė atominė masė statusas T sritis Standardizacija i mjeriteljstvo apibrėžtis Vidutinės elemento atomų masės ir 1/12 nuklido ¹²C atomo masės dalmuo. atitikmenys: engl. atomska masa; atomska težina; relativna atomska masa vok. Atommasse, f;… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
DEFINICIJA
Željezo- dvadeset šesti element periodnog sustava. Oznaka - Fe od latinskog "ferrum". Smješten u četvrto razdoblje, VIIIB skupina. Odnosi se na metale. Nuklearni naboj je 26.
Željezo je nakon aluminija najčešći metal na kugli zemaljskoj: čini 4% (tež.) zemljine kore. Željezo se nalazi u obliku raznih spojeva: oksida, sulfida, silikata. Željezo se u slobodnom stanju nalazi samo u meteoritima.
Najvažnije željezne rude uključuju magnetsku željeznu rudu Fe 3 O 4 , crvenu željeznu rudu Fe 2 O 3 , smeđu željeznu rudu 2Fe 2 O 3 × 3H 2 O i poluspratnu željeznu rudu FeCO 3 .
Željezo je srebrnasti (slika 1) duktilni metal. Dobro je podložan kovanju, valjanju i drugim vrstama mehaničke obrade. Mehanička svojstva željeza jako ovise o njegovoj čistoći - o sadržaju čak i vrlo malih količina drugih elemenata u njemu.
Riža. 1. Željezo. Izgled.
Atomska i molekularna masa željeza
Relativna molekulska težina tvari(M r) je broj koji pokazuje koliko je puta masa dane molekule veća od 1/12 mase ugljikovog atoma, i relativna atomska masa elementa(A r) - koliko je puta prosječna masa atoma kemijskog elementa veća od 1/12 mase atoma ugljika.
Budući da u slobodnom stanju željezo postoji u obliku monoatomskih molekula Fe, vrijednosti njegovih atomskih i molekularnih masa se podudaraju. Oni su jednaki 55,847.
Alotropija i alotropske modifikacije željeza
Željezo tvori dvije kristalne modifikacije: α-željezo i γ-željezo. Prvi od njih ima kubičnu rešetku usredotočenu na tijelo, a drugi ima kubičnu rešetku usredotočenu na lice. α-Željezo je termodinamički stabilno u dva temperaturna područja: ispod 912 o C i od 1394 o C do tališta. Talište željeza je 1539 ± 5 o C. Između 912 o C i od 1394 o C γ-željezo je stabilno.
Temperaturni rasponi stabilnosti α- i γ-željeza određeni su prirodom promjene Gibbsove energije obiju modifikacija s temperaturnim promjenama. Na temperaturama ispod 912 o C i iznad 1394 o C, Gibbsova energija α-željeza manja je od Gibbsove energije γ-željeza, au području 912 - 1394 o C veća.
Izotopi željeza
Poznato je da se željezo u prirodi nalazi u obliku četiri stabilna izotopa 54 Fe, 56 Fe, 57 Fe i 57 Fe. Njihovi maseni brojevi su 54, 56, 57 odnosno 58. Jezgra atoma izotopa željeza 54 Fe sadrži dvadeset i šest protona i dvadeset i osam neutrona, a ostali izotopi od nje se razlikuju samo po broju neutrona.
Postoje umjetni izotopi željeza s masenim brojevima od 45 do 72, kao i 6 izomernih stanja jezgri. Najdugovječniji među gore navedenim izotopima je 60 Fe s vremenom poluraspada od 2,6 milijuna godina.
Ioni željeza
Elektronska formula koja pokazuje orbitalnu distribuciju elektrona željeza je sljedeća:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2 .
Kao rezultat kemijske interakcije, željezo odustaje od svojih valentnih elektrona, tj. je njihov donor i pretvara se u pozitivno nabijen ion:
Fe 0 -2e → Fe 2+ ;
Fe 0 -3e → Fe 3+.
Molekula i atom željeza
U slobodnom stanju željezo postoji u obliku jednoatomnih molekula Fe. Evo nekih svojstava koja karakteriziraju atom i molekulu željeza:
Legure željeza
Do 19. stoljeća legure željeza uglavnom su bile poznate po svojim legurama s ugljikom, zvanim čelik i lijevano željezo. Međutim, kasnije su stvorene nove legure na bazi željeza koje sadrže krom, nikal i druge elemente. Trenutačno se legure željeza dijele na ugljične čelike, lijevano željezo, legirane čelike i čelike s posebnim svojstvima.
U tehnici se legure željeza obično nazivaju željezni metali, a njihova proizvodnja crna metalurgija.
Primjeri rješavanja problema
| Vježbajte | Elementarni sastav tvari je sljedeći: maseni udio elementa željeza je 0,7241 (ili 72,41%), maseni udio kisika je 0,2759 (ili 27,59%). Izvedite kemijsku formulu. |
| Riješenje | Maseni udio elementa X u molekuli sastava NX izračunava se pomoću sljedeće formule: ω (X) = n × Ar (X) / M (HX) × 100 %. Označimo broj atoma željeza u molekuli s "x", broj atoma kisika s "y". Nađimo odgovarajuće relativne atomske mase elemenata željeza i kisika (zaokružit ćemo vrijednosti relativnih atomskih masa preuzetih iz periodnog sustava D.I. Mendeljejeva na cijele brojeve). Ar(Fe) = 56; Ar(O) = 16. Postotni sadržaj elemenata dijelimo na pripadajuće relativne atomske mase. Tako ćemo pronaći odnos između broja atoma u molekuli spoja: x:y= ω(Fe)/Ar(Fe) : ω(O)/Ar(O); x:y = 72,41/56: 27,59/16; x:y = 1,29 : 1,84. Uzmimo najmanji broj kao jedan (tj. podijelimo sve brojeve s najmanjim brojem 1,29): 1,29/1,29: 1,84/1,29; Prema tome, najjednostavnija formula za spoj željeza i kisika je Fe 2 O 3. |
| Odgovor | Fe2O3 |
Fizička svojstva željeza ovise o njegovoj čistoći. Čisto željezo je prilično duktilan metal srebrnastobijele boje. Gustoća željeza je 7,87 g/cm3. Talište je 1539 ° C. Za razliku od mnogih drugih metala, željezo pokazuje magnetska svojstva.
Čisto željezo je prilično stabilno na zraku. U praksi se koristi željezo koje sadrži nečistoće. Kada se zagrije, željezo je prilično aktivno prema mnogim nemetalima. Razmotrimo kemijska svojstva željeza na primjeru interakcije s tipičnim nemetalima: kisikom i sumporom.
Kada željezo izgara u kisiku, nastaje spoj željeza i kisika koji se naziva željezni kamenac. Reakcija je popraćena oslobađanjem topline i svjetlosti. Napravimo jednadžbu za kemijsku reakciju:
3Fe + 2O 2 = Fe 3 O 4
Kada se zagrije, željezo burno reagira sa sumporom pri čemu nastaje željezov(II) sulfid. Reakcija je također popraćena oslobađanjem topline i svjetlosti. Napravimo jednadžbu za kemijsku reakciju:
Željezo se široko koristi u industriji i svakodnevnom životu. Željezno doba je doba u razvoju čovječanstva koje je počelo početkom prvog tisućljeća prije Krista u vezi sa širenjem taljenja željeza i izradom željeznog oruđa i vojnog oružja. Željezno doba zamijenilo je brončano doba. Čelik se prvi put pojavio u Indiji u desetom stoljeću prije Krista, a lijevano željezo tek u srednjem vijeku. Čisto željezo koristi se za izradu jezgri transformatora i elektromagneta, kao i za proizvodnju specijalnih legura. Najčešće korištene legure željeza u praksi su lijevano željezo i čelik. Lijevano željezo koristi se u proizvodnji odljevaka i čelika, čelik se koristi kao konstrukcijski i alatni materijal koji je otporan na koroziju.
Pod utjecajem atmosferskog kisika i vlage, legure željeza se pretvaraju u hrđu. Produkt hrđanja može se opisati kemijskom formulom Fe 2 O 3 xH 2 O. Jedna šestina otopljenog lijevanog željeza uništava se hrđanjem, pa je pitanje borbe protiv korozije vrlo važno. Metode zaštite od korozije vrlo su raznolike. Najvažniji od njih: zaštita metalne površine premazom, stvaranje legura s antikorozivnim svojstvima, elektrokemijski agensi, promjena sastava okoliša. Zaštitne prevlake dijelimo u dvije skupine: metalne (premazivanje željeza cinkom, kromom, niklom, kobaltom, bakrom) i nemetalne (lakovi, boje, plastika, guma, cement). Uvođenjem posebnih aditiva u sastav legura dobiva se nehrđajući čelik.
Željezo. Pojava željeza u prirodi
Željezo. Rasprostranjenost željeza u prirodi. Biološka uloga željeza
Drugi važan kemijski element nakon kisika, čija će se svojstva proučavati, je Ferum. Željezo je metalni element koji tvori jednostavnu tvar željezo. Željezo je dio osme skupine sekundarne podskupine periodnog sustava elemenata. Prema broju skupine maksimalna valencija željeza trebala bi biti osam, međutim, u spojevima Feruma ono češće pokazuje valenciju dva i tri, kao i poznati spojevi s valencijom željeza od šest. Relativna atomska masa željeza je pedeset šest.
Po zastupljenosti u zemljinoj kori Ferum je na drugom mjestu među metalnim elementima nakon aluminija. Maseni udio željeza u zemljinoj kori iznosi gotovo pet posto. Željezo se vrlo rijetko nalazi u prirodnom stanju, obično samo u obliku meteorita. U tom su obliku naši preci mogli prvi put upoznati željezo i cijeniti ga kao vrlo dobar materijal za izradu alata. Vjeruje se da je željezo glavna komponenta zemljine jezgre. Ferum se u prirodi najčešće nalazi u rudama. Najvažniji od njih su: magnetna željezna ruda (magnetit) Fe 3 O 4, crvena željezna ruda (hematit) Fe 2 O 3, smeđa željezna ruda (limonit) Fe 2 O 3 nH 2 O, željezni pirit (pirit) FeS 2 , željezna ruda (siderit) FeCO3, getit FeO (OH). Vode mnogih mineralnih izvora sadrže Fe (HCO 3) 2 i neke druge soli željeza.
Željezo je vitalni element. U ljudskom tijelu, kao i kod životinja, željezo je prisutno u svim tkivima, no najveći dio (oko tri grama) koncentriran je u krvnim stanicama. Atomi željeza zauzimaju središnji položaj u molekulama hemoglobina; hemoglobin duguje svoju boju i sposobnost vezivanja i uklanjanja kisika na njih. Željezo je uključeno u proces prijenosa kisika iz pluća u tkiva tijela. Dnevna potreba organizma za Ferumom je 15-20 mg. Njegova ukupna količina ulazi u ljudsko tijelo s biljnom hranom i mesom. Uz gubitak krvi, potreba za Ferumom premašuje količinu koju osoba prima hranom. Nedostatak željeza u tijelu može dovesti do stanja koje karakterizira smanjenje broja crvenih krvnih stanica i hemoglobina u krvi. Suplemente željeza treba uzimati samo prema preporuci liječnika.
Kemijska svojstva kisika. Reakcije spojeva
Kemijska svojstva kisika. Reakcije spojeva. Pojam oksida, oksidacije i gorenja. Uvjeti za nastanak i prestanak gorenja
Kada se zagrijava, kisik snažno reagira s mnogim tvarima. Dodate li vrući ugljen C u posudu s kisikom, on se užari i gori. Napravimo jednadžbu za kemijsku reakciju:
C + ONaHCO 2 = CONaHCO 2
Sumpor S gori u kisiku svijetlim plavim plamenom pri čemu nastaje plinovita tvar - sumporov dioksid. Napravimo jednadžbu za kemijsku reakciju:
S + ONaHCO 2 = SONaHCO 2
Fosfor P gori u kisiku svijetlim plamenom stvarajući gusti bijeli dim, koji se sastoji od čvrstih čestica fosfor (V) oksida. Napravimo jednadžbu za kemijsku reakciju:
4P + 5ONaHCO 2 = 2PNaHCO 2 ONaHCO 5
Reakcijske jednadžbe za interakciju kisika s ugljenom, sumporom i fosforom objedinjuje činjenica da u svakom slučaju jedna tvar nastaje od dvije polazne tvari. Takve reakcije, u kojima od više polaznih tvari (reagensa) nastaje samo jedna tvar (produkt), nazivaju se komunikacijskim reakcijama.
Produkti međudjelovanja kisika s razmatranim tvarima (ugljen, sumpor, fosfor) su oksidi. Oksidi su složene tvari koje sadrže dva elementa od kojih je jedan kisik. Gotovo svi kemijski elementi tvore okside, osim nekih inertnih elemenata: helija, neona, argona, kriptona i ksenona. Postoje neki kemijski elementi koji se ne spajaju izravno s kisikom, kao što je Aurum.
Kemijske reakcije tvari u interakciji s kisikom nazivaju se reakcijama oksidacije. Koncept "oksidacije" je općenitiji od koncepta "izgaranja". Izgaranje je kemijska reakcija u kojoj dolazi do oksidacije tvari uz oslobađanje topline i svjetlosti. Za izgaranje potrebni su sljedeći uvjeti: blizak kontakt zraka sa zapaljivom tvari i zagrijavanje do temperature paljenja. Za različite tvari temperatura paljenja ima različite vrijednosti. Na primjer, temperatura paljenja drvene prašine je 610 ° C, sumpora - 450 ° C, bijelog fosfora 45 - 60 ° C. Kako bi se spriječilo izgaranje, potrebno je pobuditi barem jedan od ovih uvjeta. Odnosno, potrebno je ukloniti zapaljivu tvar, ohladiti je ispod temperature paljenja i blokirati pristup kisiku. Procesi gorenja prate nas u svakodnevnom životu, stoga svaki čovjek mora poznavati uvjete za nastanak i prestanak gorenja, kao i pridržavati se potrebnih pravila za rukovanje zapaljivim tvarima.
Kruženje kisika u prirodi
Kruženje kisika u prirodi. Korištenje kisika, njegova biološka uloga
Otprilike četvrtina atoma sve žive tvari je kisik. Budući da je ukupan broj atoma kisika u prirodi stalan, jer se kisik uklanja iz zraka zbog disanja i drugih procesa, potrebno ga je nadoknaditi. Najvažniji izvori kisika u neživoj prirodi su ugljikov dioksid i voda. Kisik ulazi u atmosferu uglavnom kroz proces fotosinteze, koji uključuje ovo-o-dva. Važan izvor kisika je Zemljina atmosfera. Dio kisika nastaje u gornjim dijelovima atmosfere zbog disocijacije vode pod utjecajem sunčevog zračenja. Dio kisika otpuštaju zelene biljke tijekom procesa fotosinteze s al-dva-o i ovo-u-dva. Zauzvrat, atmosferski ovaj-o-dva nastaje kao rezultat reakcija izgaranja i disanja životinja. Atmosferski o-dva se troši na stvaranje ozona u gornjim dijelovima atmosfere, oksidativne procese trošenja stijena, u procesu disanja životinja i u reakcijama izgaranja. Transformacija ovog-o-dva u tse-o-dva dovodi do oslobađanja energije; prema tome, energija se mora potrošiti da se ovo-o-dva pretvori u o-dva. Ispostavlja se da je ova energija Sunce. Dakle, život na Zemlji ovisi o cikličkim kemijskim procesima koje omogućuje sunčeva energija.
Upotreba kisika je zbog njegovih kemijskih svojstava. Kisik se široko koristi kao oksidacijsko sredstvo. Koristi se za zavarivanje i rezanje metala, u kemijskoj industriji - za dobivanje raznih spojeva i intenziviranje nekih proizvodnih procesa. U svemirskoj tehnologiji, kisik se koristi za sagorijevanje vodika i drugih vrsta goriva, u zrakoplovstvu - kada se leti na velikim visinama, u kirurgiji - za podršku pacijentima s poteškoćama u disanju.
Biološka uloga kisika određena je njegovom sposobnošću podržavanja disanja. Čovjek pri disanju unutar jedne minute prosječno potroši 0,5 dm3 kisika, tijekom dana - 720 dm3, a tijekom godine - 262,8 m3 kisika.
1. Reakcija toplinske razgradnje kalijeva permanganata. Napravimo jednadžbu za kemijsku reakciju:
Tvar kalij-mangan-o-četiri široko je rasprostranjena u svakodnevnom životu pod nazivom "kalijev permanganat". Kisik koji nastaje očituje se tinjajućim iverjem, koji bljesne na otvoru izlazne cijevi za plin uređaja u kojem se odvija reakcija ili kada se unese u posudu s kisikom.
2. Reakcija razgradnje vodikovog peroksida u prisutnosti mangan (IV) oksida. Napravimo jednadžbu za kemijsku reakciju:
Vodikov peroksid također je dobro poznat iz svakodnevnog života. Može se koristiti za liječenje ogrebotina i manjih rana (al-two-o-two wt tri postotna otopina trebala bi biti u svakom priboru za hitne slučajeve). Mnoge kemijske reakcije se ubrzavaju u prisutnosti određenih tvari. U ovom slučaju reakciju razgradnje vodikovog peroksida ubrzava mangan-o-dva, ali sam mangan-o-dva se ne troši i nije dio proizvoda reakcije. Mangan-o-two je katalizator.
Katalizatori su tvari koje ubrzavaju kemijske reakcije, a da se ne troše. Katalizatori se ne koriste samo u kemijskoj industriji, već igraju i važnu ulogu u ljudskom životu. Prirodni katalizatori, zvani enzimi, uključeni su u regulaciju biokemijskih procesa.
Kisik je, kao što je ranije navedeno, malo teži od zraka. Stoga se može skupiti istiskivanjem zraka u posudu postavljenu s otvorom prema gore.
Obnovili su ga drvenim ugljenom u kovačnici (vidi), sagrađenoj u jami; u kovačnicu su upumpavali mijehove, proizvod, kritsu, udarcima su odvajali od troske i od nje su kovali razne proizvode. Kako su se poboljšavali načini puhanja i povećavala visina ložišta, proces se povećavao i dio se karburizirao, tj. dobivalo se lijevano željezo; ovaj relativno krhki proizvod smatran je proizvodnim otpadom. Otuda naziv lijevanog željeza "svinja", "svinja" - engleski sirovo željezo. Kasnije je primijećeno da se pri utovaru lijevanog željeza, a ne željeza u kovačnicu, također dobiva željezno tijesto s niskim udjelom ugljika, a takav dvostupanjski postupak (vidi Krichny preraspodjela) pokazao se isplativijim od procesa puhanja sira. U 12.-13.st. metoda vrištanja bila je već raširena. U 14.st Lijevano željezo počelo se taliti ne samo kao poluproizvod za daljnju preradu, već i kao materijal za lijevanje raznih proizvoda. U isto vrijeme datira i pregradnja peći u rudnik ("kuću"), a zatim u visoku peć. Sredinom 18.st. U Europi se počeo koristiti crucible proces proizvodnje čelika, koji je bio poznat u Siriji u ranom srednjem vijeku, ali se kasnije pokazalo da je zaboravljen. Ovom se metodom čelik proizvodio taljenjem metalnih šarži u malim (tagli) iz vrlo vatrostalne mase. U posljednjoj četvrtini 18.st. Počeo se razvijati pudling proces pretvaranja lijevanog željeza u vatreno reflektirajuće ognjište (vidi Pudling). Industrijska revolucija 18. - ranog 19. stoljeća, izum parnog stroja, izgradnja željeznica, velikih mostova i parne flote stvorili su veliku potrebu za njim. Međutim, svi postojeći načini proizvodnje nisu mogli zadovoljiti potrebe tržišta. Masovna proizvodnja čelika započela je tek sredinom 19. stoljeća, kada su razvijeni Bessemerov, Thomasov i otvoreni procesi. U 20. stoljeću Pojavio se i raširio proces taljenja u električnim pećima, proizvodeći čelik visoke kvalitete.
Rasprostranjenost u prirodi. Po sadržaju u litosferi (4,65% mase) nalazi se na drugom (prvom) mjestu. Snažno migrira u zemljinoj kori, formirajući oko 300 (itd.). aktivno sudjeluje u magmatskim, hidrotermalnim i supergenskim procesima, koji su povezani s formiranjem različitih vrsta njegovih naslaga (vidi Željezo). - dubinama zemlje, akumulira se u ranim stadijima magme, u ultrabazičnim (9,85%) i bazičnim (8,56%) (u granitima ga ima samo 2,7%). B se nakuplja u mnogim morskim i kontinentalnim sedimentima, tvoreći sedimentne naslage.
Sljedeća su fizikalna svojstva koja se prvenstveno odnose na one s ukupnim sadržajem nečistoća manjim od 0,01% po masi:
Osebujna interakcija sa. Koncentrirani HNO 3 (gustoće 1,45 g/cm 3) pasivizira zbog pojave zaštitnog oksidnog filma na njegovoj površini; razrijeđeni HNO 3 se otapa u Fe 2+ ili Fe 3+, reducira se u MH 3 ili N 2 O i N 2.
Prijem i prijava. Čisti se dobiva u relativno malim količinama vodenog ili njega. Razvija se metoda za izravno dobivanje iz. Proizvodnja prilično čistih metala postupno raste, bilo izravno iz koncentrata rude ili iz ugljena na relativno niskim razinama.
Najvažnija moderna tehnologija. U svom čistom obliku, zbog niske vrijednosti, praktički se ne koristi, iako se u svakodnevnom životu proizvodi od čelika ili lijevanog željeza često nazivaju "željezom". Rasuti se koristi u obliku vrlo različitih sastava i svojstava. Čini otprilike 95% svih metalnih proizvoda. Bogati (preko 2% težine) lijevano željezo tali se u visokim pećima iz obogaćenog željeza (vidi Proizvodnja visokih peći). Čelik različitih klasa (sadržaj manji od 2% težine) tali se iz lijevanog željeza u otvorenim ložištima i električnim pretvaračima (izgaranjem) viška, uklanjanjem štetnih nečistoća (uglavnom S, P, O) i dodavanjem legirajućih elemenata (vidi Otvoreno -ognjište, pretvarač). Visokolegirani čelici (s visokim sadržajem drugih elemenata) tale se u elektroluku i indukciji. Koriste se novi procesi za proizvodnju čelika i za posebno kritične namjene - vakuum, elektropretaljivanje troskom, plazma i taljenje elektronskim snopom itd. Razvijaju se metode za taljenje čelika u pogonima kontinuiranog rada koji osiguravaju visoku kvalitetu i automatizaciju procesa.
Na temelju toga nastaju materijali koji mogu podnijeti djelovanje visokih i niskih, te visokih, agresivnih okolina, visokih izmjeničnih napona, nuklearnog zračenja itd. Njegova proizvodnja je u stalnom porastu. Godine 1971. SSSR je proizveo 89,3 milijuna tona željeza i 121 milijun tona čelika.
L. A. Shvartsman, L. V. Vanyukova.
Kao umjetnički materijal koristi se od davnina u Egiptu (za glavu iz Tutankamonove grobnice kod Tebe, sredina 14. st. pr. Kr., Ashmolean Museum, Oxford), Mezopotamiji (bodeži pronađeni kod Karkemiša, 500. pr. Kr., British Museum , London ),
Kemija spada u prirodne znanosti. Proučava sastav, strukturu, svojstva i pretvorbe tvari, kao i pojave koje te pretvorbe prate.
Supstanca je jedan od glavnih oblika postojanja materije. Tvar kao oblik materije sastoji se od pojedinačnih čestica različitog stupnja složenosti i ima vlastitu masu, tzv.
masa mirovanja.
Jednostavne i složene tvari. Alotropija.
Sve tvari se mogu podijeliti na jednostavan I kompleks .
Jednostavne tvari sastoji se od atoma jednog kemijskog elementa, kompleks - od atoma nekoliko kemijskih elemenata.
Kemijski element - ovo je određena vrsta atoma s istim nuklearnim nabojem. Stoga, atom je najmanja čestica kemijskog elementa.
Koncept jednostavna tvar ne može se identificirati s pojmom
kemijski element . Kemijski element karakterizira određeni pozitivni naboj atomske jezgre, izotopski sastav i kemijska svojstva. Svojstva elementa odnose se na njegove pojedinačne atome. Jednostavnu tvar karakterizira određena gustoća, topljivost, talište i vrelište itd. Ta se svojstva odnose na skup atoma i različita su za različite jednostavne tvari.
Jednostavna tvar - ovo je oblik postojanja kemijskog elementa u slobodnom stanju. Mnogi kemijski elementi tvore nekoliko jednostavnih tvari koje se razlikuju po strukturi i svojstvima. Ova pojava se zove alotropija , a tvorne tvari su alotropske modifikacije . Dakle, element kisika tvori dvije alotropske modifikacije - kisik i ozon, element ugljika - dijamant, grafit, karbin, fuleren.
Pojavu alotropije uzrokuju dva razloga: različiti broj atoma u molekuli (npr. kisik OKO 2 i azon OKO 3 ) ili stvaranje raznih kristalnih oblika (primjerice, ugljik tvori sljedeće alotropske modifikacije: dijamant, grafit, karbin, fuleren), karbin je otkriven 1968. (A. Sladkov, Rusija), a fuleren je teoretski otkriven 1973. (D. Bochvar, Rusija), a 1985. - eksperimentalno (G. Kroto i R. Smalley, SAD).
Složene tvari Ne sastoje se od jednostavnih tvari, već od kemijskih elemenata. Dakle, vodik i kisik, koji su dio vode, sadržani su u vodi ne u obliku plinovitog vodika i kisika s njihovim karakterističnim svojstvima, već u obliku elementi - vodik i kisik.
Najmanja čestica tvari s molekularnom strukturom je molekula koja zadržava kemijska svojstva dane tvari. Prema modernim konceptima, molekule se sastoje uglavnom od tvari u tekućem i plinovitom stanju. Većina krutih tvari (uglavnom anorganskih) ne sastoji se od molekula, već od drugih čestica (iona, atoma). Soli, metalni oksidi, dijamant, metali itd. nemaju molekularnu strukturu.
Relativna atomska masa
Suvremene metode istraživanja omogućuju određivanje iznimno malih atomskih masa s većom točnošću. Na primjer, masa atoma vodika je 1,674 10 -27 kg, ugljik – 1,993 10 -26 kg.
U kemiji se tradicionalno ne koriste apsolutne vrijednosti atomskih masa, već relativne. Godine 1961. usvojena je jedinica atomske mase jedinica atomske mase (skraćeno a.u.m.), što je 1/12 dio mase atoma izotopa ugljika 12 S.
Većina kemijskih elemenata ima atome različitih masa (izotope). Zato relativna atomska masa (ili samo atomska masa) A r kemijskog elementa je vrijednost jednaka omjeru prosječne mase atoma elementa prema 1/12 masa atoma ugljika 12 S.
Atomske mase elemenata su A r, gdje je indeks r– početno slovo engleske riječi relativna – srodnik. Postovi A r (H), A r (O) A r (C) srednja vrijednost: relativna atomska masa vodika, relativna atomska masa kisika, relativna atomska masa ugljika.
Relativna atomska masa jedna je od glavnih karakteristika kemijskog elementa.